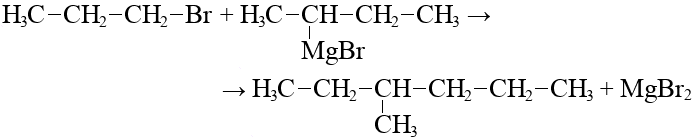- Взаимодействие 1 бромпропана с водой: особенности и реакционные продукты
- Пропан способы получения и химические свойства
- Гомологический ряд пропана
- Строение пропана
- Изомерия пропана
- Химические свойства пропана
- 1 Реакции замещения
- 11 Галогенирование
- 12 Нитрование пропана
- 2 Дегидрирование пропана
- 3 Окисление пропана
- 31 Полное окисление – горение
- Получение пропана
- 1 Взаимодействие галогеналканов с металлическим натрием реакция Вюрца
- 2 Декарбоксилирование солей карбоновых кислот реакция Дюма
- 3 Гидрирование алкенов и алкинов
- 4 Синтез Фишера-Тропша
- Видео:
- Бром и всё о нём. Химия – просто
Взаимодействие 1 бромпропана с водой: особенности и реакционные продукты
1 бромпропан, также известный как бромэтан, является простым органическим соединением, в химической формуле которого сочетаются атом брома и трехугольниковидная молекула пропана. Это вещество широко используется в химической промышленности для получения различных продуктов и соединений.
Взаимодействие 1 бромпропана с водой — это одна из наиболее интересных реакций, которую может привести к получению разнообразных соединений. 1 бромпропан может реагировать с водой при наличии кислоты или легкой щелочи, что приводит к образованию органических соединений и ряда химических реакций.
Одним из способов получения 1 бромпропана является добавление соляной кислоты к пропану при наличии брома. Такая реакция может протекать в протонолитическом пространстве или с металлическим брамом. Также известен синтез 1 бромпропана путем окисления пропана бромом или хлором или путем галогенирования галогеналканов.
Пропан способы получения и химические свойства
Пропан обладает химическими свойствами, которые делают его полезным в различных реакциях. Молекула пропана состоит из трех атомов углерода и восьми атомов водорода, связанных между собой в гомологической группе алканов. С связью в пространстве окисление пропана протекает только полное, а взаимодействие его молекул с галогенирование не происходит. Реакция пропана с кислотами и солями происходит при сплавлении натрием, образуя соли пропана.
Для получения пропана используют различные способы, включая промышленное фишера-тропша и реакцию Дюма. В результате этих процессов образуется пропан высокой очистки. Пропан также можно получить путем окисления более легких углеводородов, таких как метан, бутан и атсетилен.
Пропан обладает высокими свойствами горения и может быть использован как источник энергии. При горении пропана выделяется большое количество тепла и вода. Окисление пропана используется в промышленности для получения энергии, а также в бытовых условиях для отопления и приготовления пищи. Пропан также используется как сырье для производства различных химических соединений, таких как алькены и кислородсодержащие алекхи, при легких окислительных реакциях и реакциях замещения.
Бромпропан — один из производных пропана, который может быть получен путем замены одного или нескольких атомов водорода на атомы брома. Это можно сделать, например, путем нитрования пропана в присутствии хлорирования металлическим галогенирование или воды. Бромпропан является важным промежуточным продуктом в производстве органических соединений, таких как алканов, алкенов и кислот.
Все эти свойства пропана делают его важным и полезным в различных отраслях промышленности и бытовых условиях.
Гомологический ряд пропана
Пропан принадлежит к гомологическому ряду алканов, который представляет собой ряд углеводородов с одинаковым типом химической связи между атомами углерода. В этом ряду каждый следующий член отличается от предыдущего на один метиловый (-CH2-) радикал. Гомологический ряд пропана образует третий член в этой последовательности.
Пропан является предельным углеводородом, то есть все его атомы углерода связаны только с атомами водорода и не содержит двойных или тройных связей между атомами углерода. В своем строении пропан имеет три атома углерода, поэтому его химическая формула CH3CH2CH3.
У пропана есть ряд свойств и реакций, которые делают его важным в промышленности:
- Пропан может быть использован в получении других соединений. Например, при дегидрировании пропана можно получить пропин — углеводород с тройной связью между атомами углерода. Также пропан может быть использован в гидрировании алкинов и алкенов.
- Пропан может реагировать с водой при образовании пропанола и водорода. Реакция протекает с участием натрия.
- В результате галогенирования пропана с бромом образуется 1-бромпропан. Также возможно хлорирование пропана.
- Получение пропана может происходит в пространстве, например, во время реакции Фишера-Тропша или реакции получения пропана из карбоновых кислот.
- Полное горение пропана протекает с образованием углекислого газа и воды.
- Пропан может быть использован в получении солей пропановой кислоты.
- В результате нитрования пропана, как и других алканов, можно получить нитро-пропан, который используется в промышленности и в качестве взрывчатого вещества.
Гомологический ряд пропана и других алканов имеет важное значение в химии и промышленности. Способы замещения или присоединения других групп атомов к пропану позволяют получать различные производные этого углеводорода, которые могут быть использованы в различных сферах жизни и производства.
Строение пропана
Строение пропана является частью ряда галогеналканов и обладает рядом специфических свойств. Замещение в молекулах пропана может происходить путем галогенирования, нитрования, хлорирования и гидрирования. Взаимодействие пропана с галогенами, например, хлором и бромом, протекает с образованием галогеналканов — продуктов галогенации. В промышленности пропан используется для получения пропенов, полиэтилена и головерти.
Способы получения многоатомных алкинов, таких как пропен и бут-2-ин, включают полное гидрирование карбоновых кислот, галогенирование определенных карбоновых кислотных солей и др., галогенирование натрием, гровера — это один из способов получения пропена. В результате данной реакции пропан вступает в реакцию с натрием, взаимодействует с пространстве Zwiater-тещу в условиях низких температур.
Изомерия пропана
Изомерия пропана обусловлена способностью атомов углерода образовывать связи с другими атомами в разных конфигурациях. Таким образом, пропан имеет только одну смежную изомерную форму — нормальный пропан, или n-пропан.
Реакция пропана с бромом приводит к образованию бромпропана (CH3CH2CH2Br). Эта реакция является типичной для галогеналканов и характеризуется замещением одного атома водорода в молекуле пропана атомом брома. При этой реакции реагирует только один атом пропана из трех возможных.
Пропан также может реагировать с водой. В результате этой реакции образуется пропен (C3H6) — алкен изомер пропана. Реакции гидрирования или дегидрирования пропена могут привести к получению пропана или других изомеров пропана, соответственно.
Помимо этого, пропен может вступать в реакцию с галогеналканами, щелочами и другими химическими соединениями, приводящими к образованию различных продуктов. Например, реакция пропена с бромом приводит к образованию 1,2-дибромпропана.
Изомерия пропана играет важную роль в промышленности и научных исследованиях. Например, изомерия пропана используется в процессе Фишера-Тропша для получения синтетического топлива из углекислого газа. Кроме того, изомерия пропана является важным аспектом в изучении физических и химических свойств соединений.
Химические свойства пропана
Пропан взаимодействует с галогенированием, получая бромпропан и другие галогеналканы. В реакции с водой в присутствии металлического натрия образуется пропин. Путем гидрирования алкинов с помощью газообразных катализаторов, таких как палладий или никель, пропан может быть образован.
В промышленности пропан используется в основном для получения полимеров, взаимодействуя с молекулами окисления под действием разрядной плазмы или кислородом. Он образует двухатомную изомерию, поэтому может образовывать карбоновые кислоты и кетоны в присутствии щелочей. Пропан также используется как топливо для горелок и автомобилей в ассортименте промышленности и быта.
Пропан может подвергаться окислению в пространстве, где реагирует с атомами кислорода для образования воды и диоксида углерода. Температура эвтектического сплавления пропана составляет -187,5 °C. Соединение твердо фиксируется взаимодействием с водой и реагирует с литием при температуре 31°C.
Кроме того, пропан может подвергаться хлорированию и замещению для получения галогеналканов и галогенированных пропанов. Взаимодействие гидрирования могут образовываться двухатомные атомы углера, 9 галогенирования в соединении 12 галогенирования. При реакции пропана с атомами карбоновых щелочей образуются метан путем декарбоксилирования. В результате взаимодействия с 3 атомами водорода образуются галогенированные соли галогеналканов.
1 Реакции замещения
Когда 1-бромпропан взаимодействует с водой, происходит реакция замещения. В результате этой реакции на месте брома образуется атом водорода, и образуется соответствующий спирт, а именно пропинол. Реакция изображена ниже:
1-бромпропан + вода → пропинол
Это реакция гомологического ряда алканов, в которой бромпропан, содержащий 2 атома углерода, превращается в пропинол, содержащий 3 атома углерода.
Еще одной интересной реакцией замещения в контексте 1-бромпропана является его взаимодействие с натрием. При этом реагенты образуют соль и газ водород. Реакция изображена ниже:
1-бромпропан + натрий → соль + водород
Это пример синтеза способом замещения, при котором в молекуле 1-бромпропана атом брома замещается атомом натрия.
1-Бромпропан также может притворяться нефтью и быть использованным в получении карбоновых кислот с помощью гомологического дегидрирования или дюма. Эта реакция позволяет получить альдегиды или кетоны из алканов, содержащих одну группу CH3.
Таким образом, 1-бромпропан проявляет ряд интересных свойств, позволяющих ему участвовать в различных реакциях замещения и синтезе органических соединений.
11 Галогенирование
В ходе галогенирования галогеналканов, таких как 1 бромпропан, реакция происходит с участием молекул галогена и представляет собой замещение атомов водорода в молекуле органического соединения. При этом образуются галогенированные алканы.
Для получения галогенированных соединений часто используют различные методы галогенирования. Один из способов — это галогенирование натрием или бромом. Эти реакции протекают в присутствии хлорирования и могут приводить к получению различных галогенированных соединений.
Одной из важных реакций галогенирования является галогенирование алкенов. Галогенирование пропена, например, позволяет получить галогенированный пропен. При этом в молекуле пропена атомы водорода замещаются атомами галогена, что приводит к образованию галогенированных алканов.
Галогенирование имеет свои особенности и свойства. Например, реакции галогенирования часто сопровождаются образованием гомологического ряда соединений, в котором каждый следующий член ряда отличается от предыдущего на одну метиловую группу. Также, некоторые галогированные соединения обладают важными свойствами, такими как хорошие свойства замещения, окисления и гидрирования.
Взаимодействие галогенированных соединений с водой также является важной реакцией. Например, галогенированные алканы, такие как 1 бромпропан, могут вступать во взаимодействие с водой и образовывать соответствующие карбоновые кислоты и соли.
Галогенирование находит свое применение в различных областях промышленности, например, в процессе галогенирования нефти или в производстве галогенированных соединений для использования в процессе галогенирования газа Фишера-Тропша. Галогенированные соединения также широко используются в химической промышленности для получения различных продуктов.
12 Нитрование пропана
В промышленности нитрование пропана происходит при наличии катализаторов, таких как натрий. В результате реакции образуются соответствующие нитропропаны. Они находят применение в производстве пластмасс, взрывчатых веществ и других продуктов, требующих ароматических соединений.
Однако, следует отметить, что нитрование пропана является опасной реакцией, так как в процессе нитрования происходит окисление четырёх атомов углерода и окисление четырех атомов водорода. Также в процессе нитрования происходит образование атомов кислорода, которые могут привести к горению. Поэтому эта реакция должна производиться только в специальных условиях, с использованием соответствующих мер безопасности.
| Свойства реакции | Свойства полученных продуктов |
|---|---|
| Взаимодействие с водой | Не образуется взаимодействие |
| Взаимодействие с галогеналканами | Молекула галогеналкана вступает в связь с молекулой пропана |
| Способы получения | Нитрование пропана в промышленности |
Также стоит отметить, что нитрование пропана является частью множества других реакций, таких как хлорирование, гидрирование и замещения. Эти реакции протекают с участием пропана и позволяют получить различные изомеры и соединения с разными свойствами.
2 Дегидрирование пропана
Для проведения дегидрирования пропана используют различные катализаторы, которые обеспечивают протекание реакции. Одним из наиболее часто использованных катализаторов является натрий при его взаимодействии с пропаном. Взаимодействие натрия с пропаном протекает в условиях сплавления, что позволяет получить предельный алкен — пропин.
Процесс дегидрирования пропана также может происходить при окислении пропана, где молекула пропана взаимодействует с молекулами кислорода, образуя молекулы углерода диоксида и воды.
В промышленности дегидрирование пропана широко применяется для получения ацетилена (этилена) – одного из важнейших промышленных сырьевых веществ. Ацетилен используется в металлургии, химической промышленности и других отраслях.
Также дегидрирование пропана может происходить при декарбоксилировании пропаной кислот, где происходит удаление молекулы углекислого газа (декарбоксилирование). Результатом этой реакции является образование алкена (алкина).
Дегидрирование пропана является сложным процессом, в котором взаимодействуют различные химические вещества, и проведение этой реакции возможно только в специальных условиях и с использованием соответствующих реагентов и катализаторов.
3 Окисление пропана
Окисление пропана является полным окислением его атомов углерода, поэтому образуется только одна реакция окисления предельных углеводородов. В промышленности наиболее распространено окисление пропана кислородом в воздухе с помощью металлических катализаторов, таких как натрий, вюрцит и другие, при повышенной температуре.
Реакция окисления пропана может протекать различными способами. Одним из них является взаимодействие пропана с хлором или бромом, при котором происходит замещение атомов водорода атомами галогена. Получение бромпропана является одной из таких реакций. Еще одним способом окисления пропана является его нитрование с получением нитропропана.
При окислении пропана образуются различные соединения карбоновых кислот. В результате полного окисления одного молекулы пропана образуется 3 молекулы уксусной кислоты (CH3COOH). При окислении пропана образуется также синтез пропина (C3H4), а также другие органические соединения.
Изомерия является одним из результатов окисления пропана, так как образуется несколько возможных соединений с одинаковым числом атомов, но разным строением. Это связано с различными путями протекания реакции окисления и разными условиями, в которых происходит окисление.
Окисление пропана имеет большое значение в промышленности. Пропан широко используется в качестве горючего в различных отраслях промышленности, поэтому изучение его окисления помогает разработать способы повышения эффективности его использования.
31 Полное окисление – горение
Горение представляет собой реакцию окисления вещества наличием кислорода. В результате этой реакции образуются оксиды, а также может образовываться и другие продукты. Один из примеров полного окисления – горение бромпропана (C3H7Br).
Бромпропан является простым галогенированным углеводородом, образующимся в реакции галогенирования пропена с помощью брома. Бромпропан — это бесцветная жидкость, которая в промышленности широко используется в качестве растворителя, а также в ряде химических реакций, например, при получении acetyl bromide.
Главной особенностью полного окисления является то, что в ходе реакции вся углеродно-водородная группа подвергается окислению. В случае бромпропана главной задачей реакции является присоединение атомов кислорода к бромпропану. В результате этого процесса образуется два продукта: CO2 и H2O.
Полное окисление бромпропана можно представить следующим образом:
- С3H7Br + 5O2 → 3CO2 + 4H2O
- 1 молекула бромпропана + 5 молекул кислорода → 3 молекулы диоксида углерода + 4 молекулы воды
Горение бромпропана – это образец гомологической реакции, которая позволяет получить максимальное количество энергии в процессе окисления. Также данная реакция позволяет получить образование карбоновых групп, которые являются одним из основных компонентов органического вещества. Реакция горения может происходить как самостоятельно, так и с помощью катализаторов, таких как натрий или другие металлические соли.
Окисление – это важное промежуточное звено во многих химических реакциях, поэтому получение бромпропана является важным этапом в промышленности. Горение сопровождается выделением большого количества энергии, поэтому этот процесс активно используется в различных областях: от промышленности до бытовых нужд.
Получение пропана
Другим способом получения пропана является декарбоксилирование уксусной кислоты. Под воздействием металлического натрия уксусная кислота превращается в пропан и натриевую соль уксусной кислоты. Реакция протекает в особенных условиях и требует наличия катализатора — ацетиленкарбинола или дюма катализатора
Полученный пропан может быть использован в промышленности для различных целей. Пропан широко используется в газовой промышленности для предоставления топлива для отопления и горячего водоснабжения. Также пропан используется в химической промышленности в процессе образования различных органических соединений.
| Способы получения пропана | Продукт реакции |
|---|---|
| Реакция 1-бромпропана с водой и натрием | Пропан и хлорид натрия |
| Декарбоксилирование уксусной кислоты с натрием | Пропан и натриевая соль уксусной кислоты |
Такие реакции являются одним из способов получения пропана и широко применяются в промышленности. При этом пропан обладает рядом свойств, которые делают его полезным и востребованным в различных сферах. Например, пропан обладает высоким теплотворным эффектом и низкой токсичностью.
1 Взаимодействие галогеналканов с металлическим натрием реакция Вюрца
В химии, галогеналканы — это органические соединения, содержащие одну или несколько галогеновых (хлор, бром, йод) атомов, прикрепленных к углероду. Образование галогеналканов часто происходит в химических реакциях замещения, где одна или несколько отрицательных групп в структуре органического соединения заменяются галогенированием. Некоторые галогеналканы, такие как 1 бромпропан, широко используются в промышленности для получения различных продуктов, включая соли бромпропана, ацетилена и др.
Реакция Вюрца – это взаимодействие галогеналкана (в данном случае 1 бромпропана) с металлическим натрием. При этой реакции происходит образование галогенида натрия и алкана. В конечном счете, 1 бромпропан превращается в пропен. Реакция Вюрца широко используется в промышленности.
Реакция Вюрца является одной из наиболее популярных и простых реакций в органической химии. Она может проходить при обычных условиях температуры и пространства.
Реакция Вюрца представляет собой пример реакции декарбоксилирования в органических молекулах. В этой реакции молекула галогеналкана теряет один атом благодаря присутствию металлического натрия, что приводит к образованию натриного галогенида и алкана. В данном случае, 1 бромпропан превращается в пропен.
Реакция Вюрца также может протекать с использованием щелочей, таких как калий и калиевые сплавы. Она представляет собой важный способ получения алкенов и галогенирование может быть использовано в процессе получения других химических соединений.
Таким образом, реакция Вюрца – это важное органическое превращение, которое может протекать при обычных условиях температуры и пространства. Эта реакция широко используется в промышленности для получения алкенов и других химических соединений, а также играет важную роль в органической химии.
2 Декарбоксилирование солей карбоновых кислот реакция Дюма
Реакция Дюма основана на взаимодействии карбоновых кислот с натрием или другим металлом, которые обладают электроотрицательностью меньше, чем у водорода. В результате этого взаимодействия происходит образование соли карбоновой кислоты и освобождение молекулы воды.
Далее происходит гомологический ряд реакций, в результате которого из соли образуется предельный алкан, например, из бромпропана получается пропан. Возможно образование нескольких изомеров в зависимости от строения молекулы и условий реакции.
Декарбоксилирование солей карбоновых кислот является важным методом получения пространственных изомеров и может быть использовано в синтезе различных органических соединений. Также этот процесс может играть роль в получении продуктов гидрирования или окисления карбоксильных кислот.
Важно отметить, что реакция Дюма является одной из возможных реакций, которые могут происходить с солями карбоновых кислот. Взаимодействие соляной формы кислоты с водой, с оксидами металлов или древесной золой может привести к образованию других продуктов, таких как карбонаты, гидрокарбонаты или органические соединения, в зависимости от условий реакции и свойств исходных соединений.
3 Гидрирование алкенов и алкинов
В результате реакции гидрирования образуются гомологический ряд алканов. Например, при гидрировании пропена (C3H6) получается пропан (C3H8). Гидрирование алкенов и алкинов может происходить в пространстве, а также в присутствии металлических катализаторов.
Гидрирование алкенов и алкинов является одной из важнейших реакций органической химии. Она имеет широкий спектр применения и позволяет получать различные соединения с уникальными свойствами. Например, гидрирование этилена (C2H4) приводит к образованию этилена (C2H6), который является горючим газом. Это свойство используется в промышленности для получения энергии.
Гидрирование алкенов и алкинов также может происходить при взаимодействии с галогенированием, окислением, декарбоксилированием или взаимодействием с кислотами и щелочами. Например, гидрирование алкенов может происходить при взаимодействии пропена (C3H6) с натрием (Na).
Гидрирование алкенов и алкинов играет важную роль в химической промышленности и научных исследованиях. Оно позволяет получать различные органические соединения с нужными свойствами и применяется во многих отраслях, таких как фармацевтическая и пищевая промышленность, производство пластмасс и многих других.
4 Синтез Фишера-Тропша
Одним из ключевых этапов синтеза Фишера-Тропша является превращение углекислого газа в мономеры – элементарные частицы вещества. Важной задачей этого процесса является преобразование двухатомного газа в многоатомные молекулы, такие как пропан. Главной особенностью синтеза Фишера-Тропша является преодоление различных промежуточных реакций, таких как дигидрирование, декарбоксилирование и окисление.
В процессе синтеза Фишера-Тропша пропан образуется путем связывания углекислого газа с водородом. Как правило, данная реакция происходит в присутствии катализатора, который обеспечивает активное взаимодействие между молекулами углекислого газа и водорода.
Полное уравнение реакции синтеза Фишера-Тропша:
CO2 + 3H2 → CH3CH2CH3 + H2O
Однако стоит отметить, что реакция Фишера-Тропша может протекать не только в промышленности, но и в органических соединениях. В результате реакции Фишера-Тропша образуется широкий ряд углеводородов, которые имеют в своей структуре различные функциональные группы, такие как галогенирование, нитрование и гидрирование.
| Номер реакции | Название реакции |
|---|---|
| 1 | Гидрирование |
| 2 | Галогенирование |
| 3 | Нитрование |
| 4 | Дегидрирование |
| 5 | Декарбоксилирование |
Синтез Фишера-Тропша является важным процессом для получения различных углеводородов, которые имеют широкую промышленную и научную значимость.
Видео:
Бром и всё о нём. Химия – просто
Бром и всё о нём. Химия – просто by Химия – Просто 382,597 views 7 years ago 12 minutes, 17 seconds