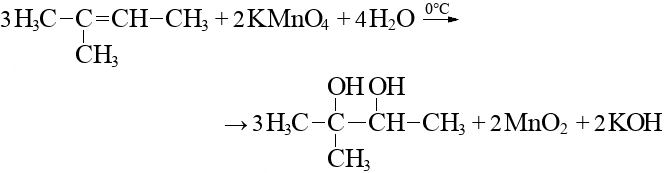- Химическое вещество 2-метилбутан образует реакцию с водой
- Бутан: способы получения и химические свойства
- Гомологический ряд бутана
- Строение бутана
- Изомерия бутана
- Структурная изомерия
- Химические свойства бутана
- 1 Реакции замещения
- 11 Галогенирование
- 12 Нитрование бутана
- 2 Дегидрирование бутана
- Сноски:
- 3 Окисление бутана
- Видео:
- ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и Получение
Химическое вещество 2-метилбутан образует реакцию с водой
2-метилбутан, также известный как изооктан, является органическим соединением, принадлежащим к классу алканов. Это популярное вещество в химической промышленности и имеет широкую область применения. Оно получается из бутана при помощи различных реакций, таких как дегидрирование, хлорирование, нитрование и др. В данной статье мы рассмотрим реакцию 2-метилбутана с водой.
Реакция 2-метилбутана с водой является одной из простых и важных реакций, которая происходит под воздействием специальных условий. Это ковалентная реакция, в ходе которой происходит взаимодействие молекулы 2-метилбутана и воды. Данный процесс может протекать при полном гидрировании алкенов, в промышленности по Фишеру-Тропшу, а также при каталитическом гидрировании на специальных катализаторах.
Результатом реакции 2-метилбутана с водой является получение смеси изомеров, как следствие изомеризации 2-метилбутана. Данная реакция имеет важное значение в органической химии, так как позволяет получать различные соединения с разными свойствами и структурой. В реакции участвуют атомы углерода, водорода и кислорода, которые образуют новые связи и образцы органических соединений.
Для осуществления данной реакции могут быть использованы разные способы, одним из которых является взаимодействие 2-метилбутана с хлорным газом. В данном случае, в результате замещения атома водорода атомом хлора, образуется соединение бутана с одним хлором. Также, в реакции может применяться натриевый карбонат (Na2CO3), который играет роль катализатора для декарбоксилирования 2-метилбутана.
Сноски:
1. Промышленность по Фишеру-Тропшу — процесс получения углеводородов из газового сырья, основанный на конверсии газообразного метана в жидкие углеводороды.
2. Реакция декарбоксилирования — процесс разложения органического соединения с образованием углекислого газа (СО2) и формированием нового соединения.
3. Нитрование — химическая реакция введения группы –NO2 в органическое соединение путем взаимодействия с азотной кислотой и кислородом.
Бутан: способы получения и химические свойства
Способы получения бутана:
- Декарбоксилирование. Бутан можно получить путем декарбоксилирования стеариновой кислоты (с17Н35-С00Н) при нагревании сильным основанием, таким как Na2CO3. Результирующими продуктами являются бутан и двуокись углерода.
- Изомеризация алканов. Одним из способов получения бутана является изомеризация других алканов, таких как пентан, при взаимодействии с каталитическими веществами. Этот процесс помогает увеличить качество и количество бутана, используемого в промышленности.
- Дегидрирование бутана. Дегидрирование бутана, то есть удаление атома водорода из его молекулы, может происходить при взаимодействии с ковалентными или металлическими каталитическими системами. Это позволяет получить более реакционноспособные соединения, такие как бутадиен, газ модифицированных карбоновых кислот и акетилен.
- Гидрирование. Гидрирование ацетилена (С2H2) под воздействием водорода на каталитическом никеле позволяет получить бутан и другие алкены. Это важный процесс в нефтеперерабатывающей промышленности и в целом в производстве углеводородов.
- Фишера-Тропша синтез. Путем взаимодействия углеродных моноксида (CO) и водорода (Н2) при высоких температурах и давлении на катализаторе можно получить бутан и другие углеводороды. Этот процесс широко используется в синтетическом производстве углеводородных соединений.
Химические свойства бутана:
- Бутан — достаточно стабильное вещество, однако его молекули могут претерпевать реакции замещения.
- Декарбоксилирование — это реакция, при которой из бутановой кислоты выделяется молекула CO2, что приводит к образованию бутана.
- Горение бутана происходит с образованием углекислого газа (СО2) и воды. Это основная реакция, используемая в бытовых газовых плитах.
- Бутан может быть нитрованным для получения нитробутанов, используемых в производстве пластмасс и синтетических волокон.
- Молекулы бутана могут подвергаться процессам изомеризации, в результате которых получаются изомеры с различными свойствами и структурой.
- Бутан может взаимодействовать с галогеналканами, образуя замещенные углеводороды.
- Бутан может реагировать с щелочами, что приводит к образованию соответствующего соли и спирта.
Бутан и его химические свойства имеют большое значение в промышленности и научных исследованиях. Изучение этих свойств помогает в дальнейшем развитии промышленных процессов и разработке новых материалов и технологий.
Гомологический ряд бутана
Бутан принадлежит к гомологическому ряду алканов, в котором каждый член отличается от предыдущего на один метиловый (-CH2-) радикал. Гомологический ряд бутана представляет собой серию изомеров, включающую молекулы с одинаковым химическим составом, но различающиеся структурой и свойствами.
Бутан встречается как природный компонент нефти и газа, а также может быть получен различными способами в промышленности. Например, получение бутана возможно в результате каталитического дегидрирования бутен-2 или взаимодействия в бутен-2 со взаимодействие с водой в присутствии каталитического натрием металлическим соединением.
Гидрирование бутена-2 может протекать при различных условиях, например, при использовании каталитического алмаза, никеля или палладия. Замещение гидрированных бутанов в галогеналканы осуществляется в реакции хлорирования, при условии, что на первом и втором атомах углерода не находятся группы, не совместимые с активным хлором.
У бутана также есть изомеры, которые отличаются расположением четырех атомов водорода на углеродной цепи. Например, изомеры бутана можно получить путем окисления бутана, окисления молекулы бутана в присутствии перекиси водорода или под действием горения вточке более продвинутого окисления. Изомерия бутана — это явление, когда молекулы имеют разные структуры, но одинаковое химическое состав.
Бутан также проявляет свойства гидрирования, окисления и нитрования. Гидрирование может происходить, например, при воздействии водорода на бутан при наличии катализатора. Окисление бутана может протекать в присутствии кислорода или перекиси водорода, что позволяет получить соответствующие оксиды.
Нитрование бутана возможно путем взаимодействия его с нитрировающей смесью, состоящей из концентрированной азотной и серной кислот. Результатом этой реакции является образование нитробутана — органического соединения с -NO2 группой. Также, бутан может быть использован в синтезе более сложных органических соединений.
Строение бутана
У бутана существует один изомер — бутен-2 (C4H8). Этот изомер содержит двойную связь между вторым и третьим углеродными атомами в молекуле. Взаимодействие бутана с щелочами (например, Na2CO3) при нагревании приводит к получению солей карбоновых кислот.
Строение бутана имеет смесь свойств, как органических, так и неорганических соединений. Например, при горении бутана происходит реакция полного окисления, в результате которой получается газ и энергия. Также бутан может взаимодействовать с водой, аммиаком и другими веществами для получения различных органических соединений.
Изомерия — одно из основных свойств бутана. Изомеры — это соединения с одинаковым химическим составом, но разным строением молекулы. Изомеры бутана образуются при обмене атомов водорода местами в молекуле. В результате этого процесса получается другой компонент с тем же химическим составом, но с разной структурой молекулы.
Бутан широко используется в промышленности, например, для получения алкинов каталитическим гидрированием бутилена. Также бутан может быть использован как горючее в природном газе или в качестве сырья для получения других органических соединений.
Взаимодействие 2-метилбутана с водой может протекать при действии каталитического гидрирования под действием металлического никеля или платины. Диаграмма Дюма позволяет получить полное описание реакции и ее результаты. Например, согласно диаграмме Дюма, при взаимодействии 2-метилбутана с водой возможно образование метанола и пропана в присутствии катализаторов.
Существуют различные способы изомеризации бутана, такие как гидрирование и замещение группы. Под действием кислот или щелочей, бутан может претерпевать изомеризацию, что приводит к получению различных изомеров в зависимости от условий реакции.
Более подробную информацию о строении бутана, его свойствах и реакциях можно найти на специализированных сайтах и в химической литературе.
Изомерия бутана
Изомерия — это явление, при котором молекулы имеют одинаковую химическую формулу, но различную структуру и свойства. В случае бутана существуют два изомера: нормальный бутан и изобутан.
Нормальный бутан, или n-бутан, имеет прямую цепь углеродных атомов. Его структурная формула представлена в следующей таблице:
| № углеродного атома | Тип атома |
|---|---|
| 1 | Метиловый |
| 2 | Метиловый |
| 3 | Этиловый |
| 4 | Метиловый |
Изобутан, или i-бутан, имеет ветвистую цепь углеродных атомов. Его структура приведена ниже:
| № углеродного атома | Тип атома |
|---|---|
| 1 | Метиловый |
| 2 | Этиловый |
| 3 | Метиловый |
| 4 | Метиловый |
У изомеров бутана различаются физические и химические свойства. Например, нормальный бутан образует смесь сжимаемых газов, тогда как изобутан является летучим газом при комнатной температуре и давлении. Это различие обусловлено разными микро- и макро свойствами молекул изомеров.
Также изомеры бутана проявляют различную активность в химических реакциях. Например, при галогенировании алканов, нормальный бутан образует большее количество продуктов, чем изобутан. Алкены, полученные путем дегидрирования бутана, выделяются при условиях повышенной температуры и металлическим катализатором.
Изомеризация бутана может происходить в промышленности под воздействием щелочей, способствующих превращению одного изомера в другой. Также изомеры бутана можно получить через реакцию окисления с помощью смеси кислот. Декарбоксилирование бутана приводит к образованию метилового радикала, который имеет свои химические свойства и взаимодействия с другими органическими соединениями. Каталитическое гидрирование бутана приводит к образованию насыщенных углеводородов, особенностями которых является горение. Реакция гидрирования бутана может проходить при нагревании в присутствии нефти или на сайте проработки с добавлением катализатора. Окисление бутана происходит при контакте с кислородом и дает цепочки веществ. Также реакция окисления может привести к образованию солей, например, Na2CO3.
Таким образом, изомерия бутана — это явление, при котором молекулы с одинаковой химической формулой имеют различную структуру и свойства. В случае бутана, существуют два изомера — нормальный бутан и изобутан, которые обладают различными свойствами и подвержены различным химическим реакциям.
Структурная изомерия
Изомерия может быть обусловлена различными факторами: группы замещения, наличие двойной связи, наличие циклической структуры, подвижность атомов и другие. Он может проявляться в разных видах, таких как гомологический ряд, алканы, алкены и алкины.
Например, для 2-метилбутана существуют три структурные изомеры: 2-метилбутан, 2,2-диметилпропан и 2,3-диметилбутан. Все эти изомеры имеют различные свойства и реакции.
Структурная изомерия может проявляться в различных химических реакциях. Например, при окислении бутана может образовываться одновременно оксид азота и углекислый газ. При декарбоксилировании карбоновых кислот с натрием происходит образование соответствующих солей.
Существуют различные способы получения структурных изомеров. Например, галогеналканы могут получаться путем хлорирования алканов. Каталитическое гидрирование алкенов может привести к образованию предельных алканов с различным расположением атомов. Также возможно декарбоксилирование карбоновых кислот при нагревании.
Структурная изомерия имеет большое значение в промышленности. Например, процесс Фишера-Тропша основан на взаимодействии углеродного газа с металлическим катализатором и позволяет получать различные изомеры углеводородов.
Описание структурной изомерии является важной составляющей изучения органической химии. Понимание этого явления позволяет более глубоко осознать свойства и реакции органических соединений и использовать их в различных областях науки и промышленности.
Химические свойства бутана
У бутана есть свойства, которые позволяют ему участвовать в различных реакциях. Полное гидрирование бутана, например, может быть достигнуто при действии каталитического натрия, при условиях промышленности. В результате этой реакции бутан превращается в метан.
Бутан также может быть использован в процессе окисления, что приводит к образованию ацетиленового соединения и других органических реакций. Галогенирование бутана может привести к образованию галогеналканов, например, 2-бутан-2-хлорида или 2-бутан-2-бромида.
Бутан может также проявлять взаимодействие с водой. При взаимодействии с водой бутан дегидрируется под действием сильных окислителей. Реакция известна как декарбоксилирование и может привести к образованию солей.
Изомеризация бутана может произойти при взаимодействии с определенными катализаторами, например, при действии хлорида алюминия. Эта реакция приводит к образованию различных изомеров бутана.
Бутан также может быть использован для синтеза других химических соединений. Например, он может быть использован для получения акетатного атома, который в свою очередь может быть использован в ряде химических реакций и промышленных процессов.
Таким образом, бутан обладает разнообразными химическими свойствами, которые позволяют ему взаимодействовать с другими веществами и применяться в различных химических процессах и реакциях.
1 Реакции замещения
Строение 2-метилбутана включает в себя молекулы с 4 углеродными атомами, которые соединены смежными связями. Реакции замещения в органических соединениях, включая 2-метилбутан, могут приводить к различным изменениям в его строении.
Одна из возможных реакций замещения 2-метилбутана с водой — это декарбоксилирование. При этой реакции одна из ацетил групп, прикрепленных к углеродному атому 3 или 4, окисляется, что приводит к образованию углекислого газа и образованию изомеров бутана.
Другой возможной реакцией замещения 2-метилбутана с водой является гидрирование. При этой реакции, под каталитическим действием, атомы водорода добавляются к молекуле 2-метилбутана, что приводит к образованию алкана без двойных связей.
В промышленности 2-метилбутан может быть использован в нескольких реакциях, таких как хлорирование, нитрование и полное горение. При хлорировании 2-метилбутана происходит замещение атомов водорода в молекуле хлорными атомами.
В реакции нитрования 2-метилбутана атомы водорода замещаются атомами нитронной группы, что приводит к образованию нитро-дериватов.
При полном горении 2-метилбутана с участием кислорода происходит окисление всех атомов углерода и водорода в молекуле, что приводит к получению диоксида углерода и воды.
Изучение реакций замещения 2-метилбутана с водой и другими реагентами может помочь улучшить понимание его химических свойств и использование в промышленности.
11 Галогенирование
Галогенирование представляет собой химическую реакцию, в которой атом или группа атомов в органическом соединении замещается атомом галогена.
Одним из способов галогенирования является замещение водорода в алканах или алкинов халогенами. Например, реакция между 2-метилбутаном и бромом протекает следующим образом:
2-метилбутан + Бр2 → бромо-2-метилбутан + HBr
Галогенирование можно провести с помощью хлора, брома или йода. Реакция протекает под действием света или при нагревании.
Галогенирование может быть также полным или частичным. В случае полного галогенирования все доступные веществу водородные атомы замещаются галогеном, а в случае частичного – только некоторые атомы.
Галогенирование является важным методом получения галогенхлоридов и галогенкарбонилов. Галогенирование является одним из способов получения галогенсодержащих веществ, которые широко используются в химической промышленности.
Галогенирование может быть каталитическим, то есть протекать при наличии катализатора. Популярным катализатором для галогенирования является фосфор.
Галогенирование имеет важное значение в органическом синтезе и промышленности. Галогенирование позволяет получать галогенсодержащие соединения, которые используются в производстве пластмасс, резиновых изделий, фармацевтических препаратов и других продуктов промышленности.
Одним из примеров галогенирования является хлорирование нефти, при котором получаются хлорированные углеводороды.
Галогенирование может также привести к образованию изомеров. Например, при галогенировании бутена-2 образуется бромо-бутен, который имеет два возможных изомера.
Галогенирование может быть частью сложной реакции, такой как дегидрирование, декарбоксилирование или изомеризация. Галогенирование может приводить к изменению структуры и свойств органического соединения.
Таким образом, галогенирование – это важное химическое взаимодействие, которое позволяет получать галогенсодержащие соединения с различными свойствами и структурой.
12 Нитрование бутана
В ходе нитрования бутана протекает несколько последовательных реакционных этапов. На первом этапе азотная кислота взаимодействует с конкретными атомами водорода молекулы бутана, образуя нитросоединение. Затем происходит образование оксония и депротонирование, что приводит к получению нитроалкана.
Структурные изомеры молекулы бутана играют значительную роль в процессе нитрования. В зависимости от расположения замещенных атомов в молекуле возможно образование различных изомеров нитроалканов. Некоторые из таких изомеров могут быть использованы в промышленности, в частности, для получения взрывчатых веществ.
Нитрование бутана можно провести с использованием различных реагентов, таких как концентрированная азотная кислота, уксусная кислота и кислородные кислоты. Также возможно использование натрия сольной кислоты, который обладает большей активностью.
Нитрование бутана может протекать при различных условиях, включая различные температуры, давление и соотношение реагентов. Также влияние на ход реакции может оказывать использование катализаторов и добавок.
Известно несколько методов получения нитроалканов из бутана. Один из таких методов включает окисление бутана азотной кислотой с помощью натрийкарбоната. Другой метод основан на окислении бутана хлорной кислотой, а третий метод включает дегидрирование бутана с использованием галогеналканов.
Свойства нитроалканов зависят от расположения нитрогруппы в молекуле. Реакция нитрования может привести к образованию различных изомеров нитроалканов с различными свойствами. Некоторые из них могут быть полезными в промышленности, например, использоваться в процессе синтеза органических соединений.
2 Дегидрирование бутана
Дегидрирование бутана может происходить под воздействием каталитического металлического натрия, а также при использовании других катализаторов, например, смеси натрия и никеля Фишера-Тропша. В результате дегидрирования образуются изомеры бутена и бутилена.
Дегидрирование бутана является одним из путей получения алкенов из алканов, и очень полезно для органического синтеза. Корпорация «Вюрца» использует эту реакцию для получения ценных сырьевых элементов для промышленности.
Дегидрирование бутана — это атомное взаимодействие молекулы бутана с металлическим натрием или другими катализаторами, в результате которого происходит удаление молекулы воды и образуются более простые молекулы алкенов.
- Происходит дегидрирование, то есть удаление молекулы воды из молекулы бутана
- Каталитическое дегидрирование бутана позволяет получить бутан из бутена
- Дегидрирование бутана протекает при нагревании в присутствии металлических натрия или других катализаторов
В результате дегидрирования бутана образуется смесь бутена и бутилена. Необходимо отметить, что процесс дегидрирования может протекать не полностью, и вместо алкена может образоваться альдегид или кетон. Это связано с тем, что дегидрирование является реакцией обратимой.
Дегидрирование бутана является важным процессом для получения алкенов, которые затем могут быть использованы для получения других продуктов химической промышленности. Одним из примеров такого использования является получение ацетилена, который является важным промежуточным продуктом в синтезе органических соединений.
Дегидрирование бутана — одна из реакций, которая может происходить с алканами — предельными углеводородами. Поэтому эта реакция имеет большое значение в органической химии.
Сноски:
- Галогенирование — реакция замещения одного или нескольких атомов водорода в молекуле органического соединения атомами галогенов (хлора, брома, йода).
3 Окисление бутана
Окисление бутана происходит при условиях, когда взаимодействие с молекулами воды приводит к образованию двух новых продуктов – группы ОН и группы СооН. Реакция может протекать при температуре 180-230˚C в присутствии катализатора.
Изомерия бутана приводит к образованию двух вариантов – нормального и изо-бутана. В процессе окисления бутана образуются как нормальные, так и изо-бутанолы.
Окисление бутана – это один из способов получения 2-октанола. Это соединение используется в промышленности для получения эфирных масел и лаков. В свою очередь, 2-октанол может быть получен из бутана в результате гидрирования и деоксигидрирования.
Также в результате окисления бутана образуется бутен-2. Молекула бутен-2 может быть использована для получения галогенированных производных и алкенопроизводных карбоновых кислот.
Углеродные кислоты и их соли, получаемые в результате окисления бутана, находят широкое применение в химической промышленности. Например, натрий карбонат (Na2CO3) получают путем окисления бутилового спирта и бутиленов с последующим реагированием с углекислым натрием. Также окисление бутана может быть использовано для синтеза других органических веществ.
Полное окисление бутана происходит при взаимодействии его с кислородом, в результате которого образуется углекислый газ и вода. Это уравнение реакции: C4H10 + 6O2 = 4CO2 + 5H2O + энергия.
Окисление бутана – это один из способов получения продуктов с гомологическим рядом. Галогенирование и хлорирование, нитрование и металлическое взаимодействие – все эти реакции протекают с участием бутана и образуют иные продукты.
Также окисление бутана может приводить к изомеризации и получению алкинов. Структура и свойства алкенов и алканов связаны с их составом и химическими свойствами. Например, связь между атомами углерода в алкенах является ковалентной и достаточно слабой, что позволяет происходить реакциям замещения и дополнительным реакциям.
Другим примером реакции, протекающей с бутаном, является синтез Фишера-Тропша. В результате этой реакции бутан может быть использован для получения углеводородов, таких как метан и этилен.
Вюрцово окисление – это еще один метод окисления бутана с помощью химических реактивов. Продуктом этой реакции является дибутаноат, который может быть использован для получения других соединений.
Итак, окисление бутана представляет собой важную реакцию, которая может привести к получению различных компонентов. Реакции окисления бутана широко используются в промышленности и представляют собой важный инструмент для синтеза и получения ценных соединений.
Видео:
ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и Получение
ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и Получение by INTENSIVKURS — Учебный Центр для Школьников 137,511 views 1 year ago 8 minutes, 44 seconds