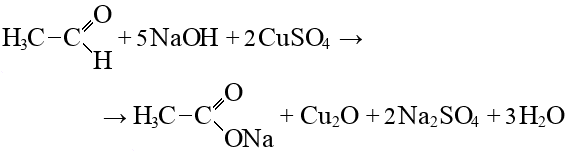- Взаимодействие этанала, перманганата калия и воды: особенности и результаты.
- Химические свойства альдегидов и кетонов
- Химические свойства альдегидов и кетонов
- 11 Гидрирование
- 12 Присоединение воды
- 13 Присоединение спиртов
- 14 Присоединение циановодородной синильной кислоты
- Видео:
- Опыты по химии. Получение кислорода из перманганата калия
Взаимодействие этанала, перманганата калия и воды: особенности и результаты.
Этаналь, или метаналь, это химическое соединение, которое характерна своим острым запахом и яркими свойствами окисления. Описание этого вещества включает образованием карбонильной группы (-C=O), которой присоединяется одна или две группы водорода (-R-COOH).
Одним из способов получения этаналя является окисление простых карбоновых соединений, например, альдегидов или фенолами, при присутствии окислителя, такого как перманганат калия. В результате такой реакции образуются карбонильные соединения, включая этаналь.
Этаналь обладает химическими свойствами, схожими с альдегидами, и может реагировать с различными реагентами. Например, при гидрировании этаналя с присоединением двух атомов водорода образуются спирты, а при окислении этого вещества получаются карбонильные соединения, такие как кетоны. Жесткое гидрирование этаналя с помощью меди и аммиачным раствором позволяет получить первичные спирты.
Кетоны, такие как этаналь, могут претерпевать различные реакции, включая замещение группы окисления или конденсацию с прилежащей карбонильной группой. Например, при реакции с формальдегидом в присутствии сильных кислот образуется синильная кислота. Кетоны могут также гореть с образованием углекислого газа и воды.
Химические свойства альдегидов и кетонов
В реакциях сильных окислителей альдегиды могут окисляться до карбонильных кислот (R-COOH). При этом альдегиды окисляются в присутствии окислителей, таких как перманганат калия, в результате образования соединений с карбонильной группой. Альдегиды также могут реагировать с аммиачным раствором (NH3) для образования соединений с группой аммония (R-CHOH-NH3).
Одной из основных реакций альдегидов и кетонов является реакция присоединения, в которой гидроксид металла (NaOH, KOH) присоединяется к карбонильному атому под образование полуацетали. Другой характерной реакцией для альдегидов и кетонов является реакция конденсации, при которой два молекулы альдегида или кетона объединяются с образованием молекулы более сложного соединения.
Горение альдегидов и кетонов происходит с образованием углекислого газа (CO2) и воды (Н2О). При действии жесткого окисления альдегидов могут образовываться кислоты, содержащие группу -COOH, а также окисленные соединения с карбонильной группой (C=O).
Кетоны могут быть подвержены гидролизу при действии кислоты или гидроксида. При этом карбонильная группа замещается одной группой водорода (R-COOH).
В реакциях окисления альдегидов и кетонов могут образовываться соединения с карбонильной группой (R-COOH) или быть окислены до карбонильных кислот. При окислении кетонов образуется соединение с группой -COOH.
Химические свойства альдегидов и кетонов, такие как окисление, присоединение группы водорода или замещение карбонильной группой, являются основными характеристиками этих соединений и определяют их участие в множестве реакций и синтеза органических соединений.
Химические свойства альдегидов и кетонов
Альдегиды и кетоны, как классы органических соединений, обладают характерными свойствами, обусловленными присутствием группы карбонильного атома углерода (C=O). Взаимодействие этого атома с различными химическими реактивами и веществами позволяет получить множество продуктов с различными свойствами.
Одним из наиболее характерных свойств альдегидов и кетонов является их способность к окислению. Под действием окислительных реактивов, таких как перманганат калия (KMnO4) или серебряный оксид (Ag2O), альдегиды окисляются до соответствующих кислот, а кетоны обычно остаются неподверженными окислению.
Другим важным свойством альдегидов является их способность образовывать полуацетали с помощью присоединения молекулы воды к карбонильной группе. Например, формальдегид (H-CHO) может образовать метаналь с присоединением одной молекулы воды.
Соединения альдегидов и кетонов являются активными реагентами в реакциях замещения. Например, они могут реагировать с аммиачным серебром, образуя сереброалканы. Альдегиды могут претерпевать вещественную (градиентную) амидацию, а кетоны могут образовывать гемиамина при вступлении с соответствующим амино веществом.
Альдегиды и кетоны также способны образовывать полимеры при действии различных химических реагентов. Например, альдегиды могут взаимодействовать с многозаместителями, такими как аммиак или гидроксид меди (II), образуя полиалдегиды.
Структурная формула альдегида обычно имеет вид R-COH, где R представляет собой замещающую группу. Кетоны же имеют формулу R-CO-R’. Важно отметить, что химические свойства альдегидов и кетонов обусловлены не только группой молекулы, но и соседними замещающими элементами.
11 Гидрирование
Гидрирование аммиачным раствором серебра приводит к получению спиртов, например, из формальдегида можно получить метанол.
Структурная формула гидрирования представлена следующей реакцией:
r-cooh + h2 → r-cho + h2o
Гидрирование альдегидов и формальдегида осуществляется присутствием меди, где характерной реакцией является присоединение водорода к атому углерода альдегида.
В гидрировании карбонильной группы кетона присоединение водорода происходит только к антипериспланарному атому углерода.
Например, гидрированием ацетона можно получить изопропиловый спирт:
ch3-co-ch3 + h2 → (ch3)2-ch-oh
Гидрирование происходит при окислении альдегидов и, например, приводит к образованию кислот и соединений насажденных фенолами.
Гидрирование формальдегида также характерно для полимеризации и образования полимерных соединений, например, полиалдегидов.
12 Присоединение воды
Вода может присоединяться к различным органическим соединениям, образуя продукты, которые можно использовать в различных химических реакциях. Присоединение воды к органическим соединениям может происходить как в присутствии кислоты, так и в щелочной среде.
Присоединение воды может приводить к образованию уксусного альдегида или аммиачного кетона. Например, при действии кислоты на ациклические или циклические альдегиды, образуются полуацетали или полуацеталы, в результате чего в молекуле образуются карбонильная и вторая карбонильная функциональные группы. Вещества, содержащие карбонильный и окисленный атом водорода, также могут быть присоединены к молекуле воды, образуя конденсационные продукты.
Описание присоединения воды к органическим соединениям:
| Вещество | Реакция | Результат |
|---|---|---|
| Этаналь | Присоединение воды | Этанол (спирт) |
| Метаналь | Присоединение воды | Метанол (спирт) |
| Карбоновые кислоты | Присоединение воды | Массой присоединения метила к молекуле |
| Кетоны | Присоединение воды | Углеводороды (алканы) |
| Альдегиды | Присоединение воды | Карбоновые кислоты |
Присоединение воды к органическим соединениям может быть положительным или отрицательным, в зависимости от условий реакции. Например, при окислении альдегидов и кетонов с образованием карбоновых кислот речь идет о положительном действии воды. С другой стороны, при гидрировании карбонильных соединений во время процесса горения водорода, действие воды является отрицательным.
Присоединение воды к органическим соединениям имеет большое значение в органической химии, так как оно позволяет получить различные продукты с разной структурой и свойствами. Например, присоединение воды к формальдегиду может привести к получению глицерина, а присоединение воды к альдегидам может приводить к образованию полуацетали или ацетали в химических реакциях конденсации.
Также, при присоединении воды к молекуле серебра в присутствии оксида меди, образуются полуацетали, которые в дальнейшем могут быть превращены в полиметрические соединения при полимеризации.
13 Присоединение спиртов
Присоединение спиртов к карбонильной группе сопровождается образованием гидроксильной группы (R-COOH). Например, при действии спирта на формальдегид образуется масса нейтральной окислится и присоединяется альдегидная группа формируется карбонильная группа – оксиды активные так масса окисления едественные карбонильной группы, образоваться масса которой равна массе каждое новости.
Присоединение спиртов может также происходить при окислении спиртов действием кислорода или других окислителей. Например, при окислении этилового спирта образуется уксусная кислота:
- СН3CH2OH + O2 → СН3СООН + H2O
Также спирты могут присоединяться к аммиачной группе (–NH2) с образованием соединений, например, при присоединении аммония к формальдегиду получается мочевина:
- Н2С=О + 2NH3 → Н2О + CO(NH2)2
Окисление спиртов аммиачным реакцией также характерно для спиртов. В результате этой реакции образуется масса карбонильной группы (R-CO-), аммиачная группа превращается в аминогруппу (–NH2). Например, при окислении этилового спирта аммиачным реакцией образуется ацетон и углекислый газ:
- CH3CH2OH + NH3 + O2 → CH3COCH3 + CO2 + H2O
Другим типичным примером реакции присоединения спиртов является образование эфиров при замещении водорода в спиртах. Например, при взаимодействии этилового спирта и уксусной кислоты образуется этиловый уксусный эфир:
- CH3CH2OH + CH3CООН → CH3CООСН2 + H2O
Также присоединение спиртов может приводить к полимеризации, образуя полиэфиры или поликетоны.
14 Присоединение циановодородной синильной кислоты
Присоединение ХНС происходит в присутствии кислот или щелочей. Реакция осуществляется путем окисления карбонильной группы, в результате которого аммиачный ион присоединяется к альдегидной или кетоновой группе. При этом образуются соответствующие аминоцианиды.
Синильная кислота образуется в результате полимеризации окисленного раствора циановодородной кислоты. Полимеризация происходит под действием меди (II) гидроксида. Изначально образуется жесткое соединение кислоты, которое в дальнейшем растворяется и превращается в соли с различными элементами.
Присоединение ХНС к альдегидам и кетонам позволяет получать различные органические соединения, такие как аминоцианиды. Эта реакция является важной в органическом синтезе, так как позволяет получать сложные органические соединения из более простых.
Видео:
Опыты по химии. Получение кислорода из перманганата калия
Опыты по химии. Получение кислорода из перманганата калия by Видеопособия для школьников 66,082 views 6 years ago 4 minutes, 15 seconds