Исследование: взаимодействие этанола с бихроматом калия, серной кислотой и водой
Этанол, обычно называемый спиртом, является одним из самых распространенных спиртов в мире. Он используется в различных отраслях промышленности и в быту. Но что происходит, когда капли этанола воздействуют на бихромат калия, серную кислоту и воду? В этой статье мы рассмотрим интересные реакции и последствия этого химического эксперимента.
В ходе опыта было обнаружено, что капля этанола, добавленная к раствору бихромата калия (K2Cr2O7) и серной кислоты (H2SO4), вызывает странное окрашивание раствора. Опытным путем было установлено, что при нагревании этанола до определенной температуры и последующем его окислении этанол претерпевает реакцию окисления.
Когда этанол нагревается и окисляется бихроматом калия, происходит образование комплексных соединений с хромом. При этом первичные спирты окисляются до альдегидов, а затем до карбоновых кислот. Результатом окисления этанола является формирование соединений, обозначаемых как Р1-СООН, Р2-СООН и Р3-СООН, где Р — органический радикал.
Этаноловый радикал (C2H5) образует комплекс соединений с хромом в виде этилового хромового капли. Они обладают характерным цветом и служат показателем окисления этанола. Таким образом, окрашивание раствора свидетельствует о наличии спирта в реакционной среде.
C2H5OH + K2Cr2O7 + H2SO4 уравнение реакции
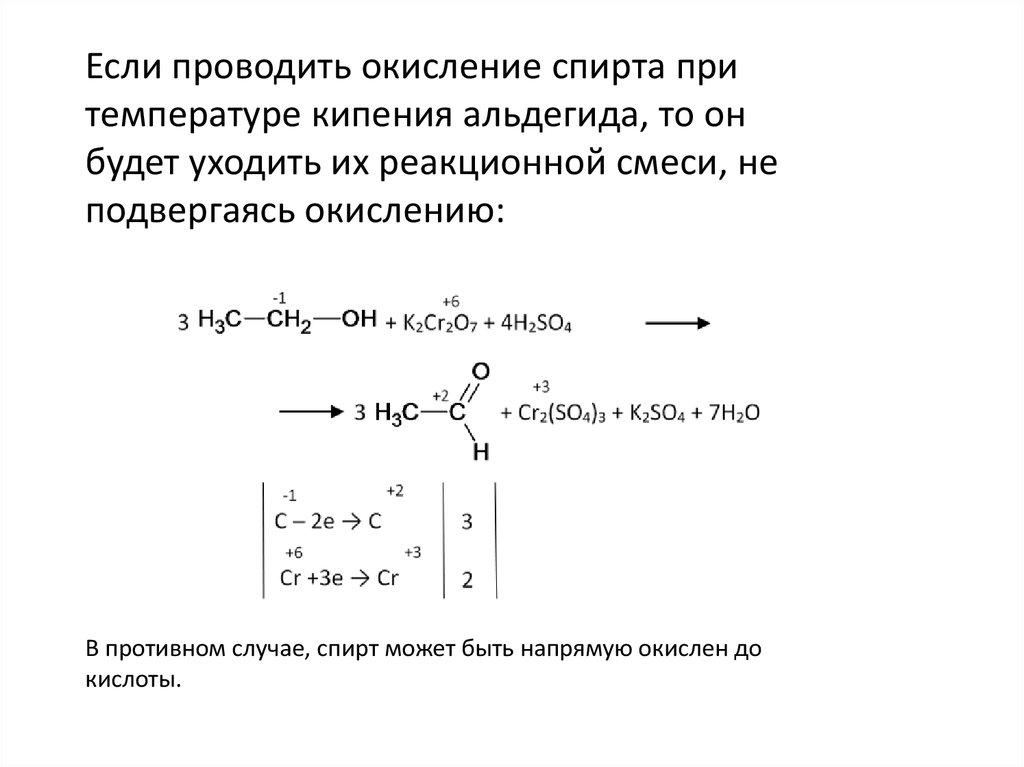
В ходе эксперимента проводится окисление этанола (C2H5OH) раствором K2Cr2O7 в присутствии H2SO4. Реакция происходит следующим образом: атомы кислорода из раствора K2Cr2O7 переносятся на атомы углерода этанола, при этом он окисляется до альдегида или карбоновой кислоты.
Этот химический процесс сопровождается интенсивным окрашиванием раствора K2Cr2O7. Сначала он окрашивается в оранжевый цвет, а затем в зеленый. Интенсивность окрашивания связана с образованием хромовой кислоты (Cr2O7-2), которая окрашивает раствор.
В результате окисления этанола образуются различные продукты, включая карбоновую кислоту или альдегиды. Например, при окислении этанола (C2H5OH) в присутствии K2Cr2O7 и H2SO4 образуется уксусная кислота (CH3COOH) и вода (H2O).
Также, при окислении этанола образуются различные комплексные соединения спирта и хрома, такие как Cr3+ со связью с атомами кислорода в спирте.
Одним из эффектов окисления этанола является образование альдегидов или карбоновых кислот, которые в дальнейшем могут превратиться в амины или алкалоиды. Также этот процесс может привести к образованию токоферолов (витамин Е) и фенола.
Окисление этанола происходит при нагревании раствора K2Cr2O7 и H2SO4 с этанолом. В процессе нагрева раствора происходит разрушение связи между хромом и кислородом, что приводит к образованию железа в растворе.
Таким образом, уравнение реакции окисления этанола (C2H5OH) равно: C2H5OH + K2Cr2O7 + H2SO4 → CH3COOH + Cr2(SO4)3 + H2O.
Данная реакция широко используется в промышленности для получения уксусной кислоты и других органических соединений.
Опыт №1 Окисление этилового спирта хромовой смесью
Химический механизм реакции
Окисление этилового спирта происходит под действием хромовой смеси, которая обычно содержит комплексные соединения хрома (VI), такие как K2Cr2O7. В среде сильной кислоты, например, H2SO4, K2Cr2O7 окисляет этанол, образуя два стабильных продукта: ацетальдегид и этилиден.
При нагревании K2Cr2O7 в присутствии H2SO4, хроматные идущие соединения окисляются, образуя окрашенную раствор, обозначающую переход Cr(VI) в Cr(III). Это переход сопровождается изменением цвета раствора от оранжевого/желтого (Cr(VI)) к зеленому (Cr(III)).
Окисление этанола хромовой смесью имеет промышленное применение в производстве ряда органических соединений, таких как ацетальдегид и фенол. Кроме того, эта реакция служит основой для получения ценных продуктов, таких как токоферолы (витамин Е).
Видео:
Правило разбавления концентрированной серной кислоты водой
Правило разбавления концентрированной серной кислоты водой by MIK 1,703 views 2 years ago 20 seconds