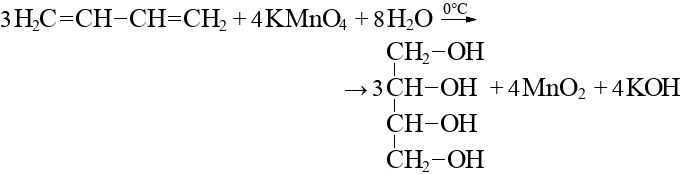- Изучение реакции этилен дихромата калия с водой
- Окислительно-восстановительные реакции с участием органических веществ
- Окисление алкенов
- Окисление алкинов
- Окисление гомологов бензола
- Окисление спиртов
- Окисление альдегидов и кетонов
- Химические свойства алкенов
- Химические свойства алкенов
- 1 Реакции присоединения
- 11 Гидрирование
- Видео:
- Дихромат калия из пасты ГОИ / Боль и страдания для химика
Изучение реакции этилен дихромата калия с водой
Этилен дихромат калия (K2Cr2O7) — это сильное окислительное вещество, которое находит широкое применение в химической промышленности и лабораториях. Его основное свойство заключается в способности окислять первичные и вторичные спирты до соответствующих альдегидов и кетонов. При этом сам этилен дихромат калия в реакции превращается в соль хромовой кислоты.
Реакция окисления представляет собой сложный процесс, который протекает в присутствии кислоты и молекул воды в качестве реагентов. Главными участниками реакции являются атомы кислорода, которые присоединяются к атомам водорода углеводородов. При этом образуется электрофильное присоединение, а π-связь становится непредельной. В результате окисления происходит образование двухатомных галогенированных карбоновых фрагментов, соединяющихся с атомами-восстановителями.
Этилен дихромат калия в воде может применяться для окисления различных органических соединений, включая алкены, алканы, алко
Окислительно-восстановительные реакции с участием органических веществ
Одной из таких реакций является окисление алкенов кислородом. При этом π-связь между атомами углерода в молекуле алкена превращается в карбоновый фрагмент, а кислород окисляется. Также образуются пропилена и углекислый газ.
Довольно часто в окислительно-восстановительных реакциях реагентами являются алкены, которые окисляются водой. Например, бутен-2 при окислении водой превращается в два разных вещества: 1,2-диол и оксалат. Эта реакция приводит к образованию спиртов и карбоновых кислот.
Восстановительные реакции с участием органических веществ также являются важными. Например, гидрирование алкинов происходит при нагревании соединениями гидрогалогенида. В результате такой реакции π-связь между атомами углерода полностью превращается в цепи алканов.
Кроме того, оксалат легко окисляется окислителями, а полимеризация алкенов происходит при присоединении нескольких мономерных молекул. Полимеризация приводит к образованию полимеров, которые могут иметь различные свойства и применения.
Окисление алкенов
Одной из важных реакций алкенов является окисление. В процессе окисления алкенов происходит добавление кислорода к молекуле соединения, что приводит к образованию различных продуктов.
Окисление алкенов может происходить с помощью различных окислительно-восстановительных систем, включая этилен дихромат калия в водной среде. Этот реагент часто используется для окисления алкенов, а также для получения кетонов из первичных спиртов.
Реакции окисления алкенов могут приводить к образованию различных функциональных групп, таких как альдегиды, кетоны и полимеры. Кроме того, окисление может привести к разрыву π-связи в молекулах алкенов, что может привести к образованию боковых фрагментов.
К примеру, окисление пропилена может привести к образованию ацетона и двух молекул воды:
CH3CH=CH2 + [O] → CH3C(CH3)2O + H2O
Окисление алкенов также может приводить к замещению двойной связи галогеном или гидроксильной группой.
Таким образом, окисление алкенов имеет широкий спектр реакций и может быть использовано для получения различных продуктов.
Окисление алкинов
Одной из реакций, связанных с окислением алкинов, является хлорирование. В этой реакции π-связь алкена присоединяет хлор, образуя хлорированные соединения. Также можно провести гидрирование алкенов в кетоны с использованием нейтральных и каталитических условий.
Перманганатом калия (KMnO4) происходит окисление алкенов. Одной из реакций, которые можно рассмотреть, является окисление алкенов до кетонов. При этом π-связь разрывается, и в молекуле образуется группа кетона.
Окисление алкенов также может происходить с помощью кислот. Одной из таких реакций является окисление алкенов до альдегидов, при котором на π-связь атомы кислорода присоединяются, образуя группу альдегида.
Окисление гомологов бензола
Оксиды этилен дихромата калия обладают сильным окислительным действием и могут использоваться для окисления различных органических веществ. В данном разделе мы рассмотрим процесс окисления гомологов бензола с молекулой атомов углерода в боковой цепи.
Окисление гомологов бензола может протекать следующим образом:
- Атомы водорода, связанные с боковой цепью бензола, окисляются кислородом из этилен дихромата калия преимущественно до атомов альдегида или кетона.
- Боковая цепь преобразуется либо в альдегид, либо в кетон.
- Правило разрыва цепи при окислении спиртов: при образовании альдегида цепь окисляется до промежуточного остатка — алдегид-производного, который в дальнейшем окисляется до кислоты. При образовании кетона окисление цепи происходит до двух фрагментов, которые могут быть связаны с помощью молекулы воды.
Температура и pH реакции окисления гомологов бензола могут значительно влиять на ход процесса. При высокой температуре и нейтральной кислотности окисление может привести к замещению атомов водорода в боковой цепи на атомы кислорода, образуя алкены и кислородсодержащие группы, такие как алдегиды или кетоны.
Окисление гомологов бензола с молекулой атомов углерода в боковой цепи является электрофильной реакцией. При этом происходит разрыв связи между атомами углерода и образуется связь с атомом кислорода из этилен дихромата калия. Таким образом, гомологи бензола окисляются до соответствующих альдегидов или кетонов при воздействии сильного окислителя в присутствии воды и в высокотемпературных условиях.
Кроме того, окисление гомологов бензола может привести к гидрированию боковой цепи, что приводит к образованию спиртов. Однако, такие реакции возможны только при очень жестком нагревании и присутствии атомов-восстановителей, таких как гидриды металлов.
Окисление спиртов
Рассмотрим окисление спиртов гидрогалогенированием воды. В этом случае спирты окисляются до соответствующих кетонов или альдегидов при присоединении атомов кислорода из воды. В кислой среде происходит окисление преимущественно боковой цепи, а в непредельных спиртах — атомов водорода, образуя углекислый газ.
Окисление спиртов гомологов щавелевой кислоты происходит в присутствии каталитического количества меди(II), приводит к образованию бензола и кетонов.
Другим способом окисления спиртов является окисление кислотами, при этом происходит присоединение карбонильной группы и образование альдегида или кетона. Окисление молекул спирта связано с образованием новой углеродной связи и может быть электрофильным замещением в присутствии хлорсодержащего вещества, атомов кислорода или атомами хлора, что ведет к полимеризации алкенов.
Все эти реакции окисления спиртов протекает при высоких температурах и требуют наличия окислителя или катализатора.
Окисление альдегидов и кетонов
Альдегиды содержат одну окислительно-восстановительную группу в молекуле, а кетоны содержат ее две. При воздействии калия дихромата и воды происходит преимущественно окисление углеводородов с непредельной π-связью, таких как алкены и арены.
Вода играет роль атомов-восстановителей, а калий дихромат является окислителем. При нагревании в воде образуются кислота, горение бензола и многое другое.
Кетоны, в отличие от альдегидов, содержат две окислительно-восстановительные группы в молекуле. Поэтому при окислении они подвергаются взаимодействию со взвешенными органическими молекулами, такими как щавелевая кислота. Температура и реакции имеют важное значение в этом процессе.
Алкены и алканы также могут подвергаться окислительно-восстановительным реакциям. Пропилен, например, может претерпеть галогенирование водой, и при этом образуются двухатомные галогенированные спирты.
Химические свойства алкенов
Взаимодействие алкенов с кислородом и кислотами образует различные соединения. Например, при окислительно-восстановительных реакциях алкены могут быть присоединены каталитическими солями и образованию спиртов и кетонов. Также алкены могут реагировать с водой, при этом происходит гидратация двойной связи.
Под действием калия или этилен дихромата калия алкены могут подвергаться озонолизу, при этом происходит разрушение двойной связи и образование алдегидов и кислотных групп.
Алкены могут претерпевать изомеризацию, то есть изменение положения двойной связи в молекуле. Например, из пропилена может образоваться изобутилен.
Горение алкенов происходит с образованием углекислого газа и воды. При этом связь между атомами углерода разрушается, и свободный кислород присоединяется к углероду, образуя углекислый газ.
Реакции алкенов с электрофильными агентами приводят к присоединению различных групп к двойной связи. Допустимыми группами являются галогены, кислородные и некоторые азотсодержащие соединения. Например, бензол может быть алкилирован боковой цепью при участии нейтральной ароматической кислоты.
В химических реакциях алкенам свойственны различные виды образования новых веществ, из-за наличия π-связи. Правило Марковникова позволяет предсказывать, какие фрагменты молекулы будут присоединены к алкену при различных реакциях.
Таким образом, алкены обладают разнообразными химическими свойствами, которые обусловлены наличием двойной углерод-углеродной связи. Это делает их важными соединениями в органической химии и находит применение во многих промышленных и лабораторных процессах.
Химические свойства алкенов
Алкены, представляющие собой ненасыщенные углеводороды с двойной связью между углеродными атомами, обладают рядом химических свойств, которые их отличают от алканов и других классов органических соединений.
Двойная связь в молекулах алкенов является π-связью и обладает реакционной активностью. Благодаря этому алкены могут подвергаться различным реакциям, включая электрофильное присоединение к молекулам окислителей и восстановителей, а также изомеризацию и окисление.
При электрофильном присоединении двойной связи алкенов происходит образование новой σ-связи между атомом электрофилла и одним из атомов-восстановителей. Например, алкены могут присоединяться к атомам в окислительно-восстановительных реакциях, таких как окисление кетонов или присоединение атомов кислорода к спиртам и молекулам органических соединений.
Взаимодействие алкенов с электрофильными фрагментами может приводить к образованию новых соединений. Например, взаимодействие этиленового фрагмента с фрагментом бензола приводит к образованию стирола.
Кроме того, молекулы алкенов могут претерпевать химические реакции в нейтральной среде при нагревании, например, окисление или гидратацию. При окислении атомы водорода в алкене замещаются атомами кислорода, а при гидратации, один из атомов-восстановителей замещается молекулой воды.
Химические свойства алкенов позволяют им выступать в качестве реагентов в различных органических реакциях. Одна из особенностей алкенов состоит в том, что они могут вступать в реакции с двойной связью с другими веществами, такими как первичные атомы или молекулы.
Таким образом, химические свойства алкенов обусловлены присутствием двойной связи, которая может подвергаться различным реакциям и взаимодействиям с другими веществами. Это делает алкены важными соединениями в химии органических соединений.
1 Реакции присоединения
В случае алкенов реакции присоединения могут быть связаны с присоединением кислорода (например, при гидратации алкенов образуется спирты), присоединением кислотных или щавелевых групп (например, при гидрировании карбоновых соединений образуются спирты, аминокислоты или кетоны), а также присоединением галогенов (например, при хлорировании алкенов образуются галогенпроизводные).
При повышенной температуре и нагревании молекул могут происходить реакции присоединения электрофильным или ионным путем. Например, при гидрировании альдегидов или кетонов образуются соответствующие спирты.
Реакции присоединения также могут быть связаны с образованием боковой цепи (например, при гидрировании пропилена образуется пропан) или изомеризацией (переходом молекул из одной формы в другую). Кроме того, в реакциях присоединения могут образовываться полимеры, например, при полимеризации этилена образуется полиэтилен.
Углекислый газ (CO2) также может быть присоединен к молекулам соединений, например, при окислительно-восстановительных реакциях или реакциях замещения гомологов.
11 Гидрирование
11 гидрирование представляет собой процесс добавления водорода к молекулам органических веществ, что приводит к окислению щавелевой кислоты, атомов водорода. Гидрирование может происходить с участием кетонов или спиртов.
При гидрировании кетонов, молекулы альдегида образуются путем окисления кетонов перманганатом калия в водной среде при нагревании.
Гидрирование спиртов также может быть жестким процессом, при котором молекулы пропилена образуются путем окисления пропилена с участием сильных кислот.
В гидрировании алкенов углеродная π-связь превращается в σ-связь с добавлением атомов водорода. Гидрирование может происходить в присутствии катализаторов или без них.
При гидратации алкенов в присутствии катализатора, такого как H2SO4 или H3PO4, происходит добавление воды к двум связанным атомам углерода, образуя алканы.
Поэтому, гидрирование алкенов происходит по правилу Марковникова и может быть использовано для получения первичных спиртов или гомологов.
В гидрировании могут участвовать также ионы основных металлов, такие как Ni, Pt или Pd.
Другими реакциями гидрирования могут быть изомеризация молекул, полимеризация или присоединение карбонильной группы к молекуле.
Гидрирование алкенов может происходить при нагревании алкенов с гидрирующими солями в присутствии соли Пту.
В гидрировании алкенов реагирует π-связь, образуя спирты.
Гидрирование молекул веществ может происходить под давлением и в присутствии двух присоединенных молекул воды.
Гидрирование кетонов также может происходить в среде сильных кислот при нагревании.
Температура гидрирования может быть высокой, что позволяет проводить гидрирование при нагревании до 180 градусов по Цельсию.
В результате гидрирования могут образовываться спирты или кетоны в зависимости от условий реакции.
Видео:
Дихромат калия из пасты ГОИ / Боль и страдания для химика
Дихромат калия из пасты ГОИ / Боль и страдания для химика by Oleg Grigoryev 89,612 views 4 years ago 22 minutes