Галогеновые алканы и их реакция с водой
Галоген алкан, в химии известный как производное органического соединения углеводорода, обладает важными свойствами и находит широкое применение в различных отраслях науки и промышленности. Получение галоген алканов осуществляется путем галогенирования углеводородов или подвергая другие соединения замещению галогена в присутствии галогенопроизводных.
При взаимодействии галоген алкана с водой происходят физические и химические реакции, в результате чего образуются галогенсодержащие соединения и гидроксиды. Один из наиболее распространенных способов получения галоген алкана из галогена и алкена — это марковникиево алкилование, в котором галоген присоединяется к алкену на наиболее замещенный углеродный атом.
Строение галоген алкана состоит из одного атома галогена, присоединенного к атому углерода. Это свойство определяет его реакционную способность и химическую активность. Важный этап в получении галоген алканов — восстановление хлоридов галогена и соединений, содержащих халидные связи, с последующей реакцией замещения. В химической схеме галогенирования галогенпроизводные являются промежуточными соединениями.
Галогеналканы
Галогеналканы образуются путем присоединения галогена к алкенам или алкинам с помощью галогенпроизводных или галогенсодержащих кислот. Этот процесс получения галогеналканов называется гидрогалогенированием. При этом происходит обмен связей между атомами углерода и галогена, и получается смесь изомеров галогеналканов.
Галогеналканы имеют различную полярность в зависимости от химической природы галогена и структуры галогеналкана. Более легкие галогеналканы, такие как хлорметан и хлорэтан, обладают меньшей полярностью по сравнению с более тяжелыми галогеналканами, например бромэтаном и иодметаном. Более полярные галогеналканы обычно обладают высокой плотностью и жидким состоянием при комнатной температуре.
Механизм образования галогеналканов включает промежуточный этап образования алкилгалогенида, который может претерпевать дальнейшие реакции, такие как элиминирование, окисление или восстановление. Изомерия галогеналканов также возможна из-за различной пространственной ориентации галогена относительно углеродных атомов в молекуле.
Галогеналканы находят применение в различных областях химии и медицины. Они могут использоваться в качестве реакционных промежуточных продуктов для получения других органических соединений, таких как алкены или алколы. Кроме того, галогеналканы могут быть использованы в качестве растворителей для качественных и количественных анализов, а также в синтезе полимеров и лекарственных препаратов.
Строение галогеналканов
Структура галогеналканов определяется взаимодействием молекул галогена с продуктами гидрогалогенирования, где заряд галогенной группы присоединяется к атому углерода, образуя алифатическое соединение. При галогенировании насыщенных углеводородов, взаимодействие галогена и углерода приводит к замещению связей и образованию галогеналканов.
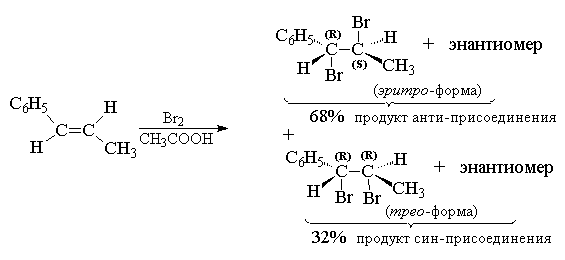
Изомеры галогеналканов могут быть получены в результате химических реакций, таких как элиминирование или оптическое вращение. Элиминирование представляет собой процесс удаления атома галогена из молекулы, что может привести к образованию нового соединения. Оптическое вращение, с другой стороны, относится к способности соединений изменять направление света при прохождении через них.
Галогеналканы имеют различные физические и химические свойства в зависимости от типа галогена и количества атомов галогена в молекуле. Например, галогеналканы с более высокой степенью галогенирования обычно обладают большей полярностью, чем те, в которых присутствуют одинаковые атомы галогена. Это влияет на их свойства, такие как точка кипения, растворимость и прочности межмолекулярных взаимодействий.
Одной из основных реакций галогеналканов является восстановление, при котором атомы галогена замещаются другими атомами или группами. Это может происходить в результате галогенирования, где атомы галогена вступают во взаимодействие с углеводородами, образуя галогенпроизводные. Качественные и количественные характеристики галогеналканов могут быть использованы для определения их структуры и механизма получения в сравнении с другими соединениями.
Номенклатура и изомерия
Галогеналканы являются хорошими сырьем для получения различных органических соединений. Влияние галогенов на химические свойства галогеналканов приводит к разнообразию продуктов при их взаимодействии с водой.
В зависимости от атома галогена, присоединенного к углеродному атому, галогеналканы могут образовывать два изомера. Например, для хлорэтана можно выделить два способа расположения атома хлора по отношению к углеродному атому:
1. Хлорэтан, в котором хлоровый атом присоединен к первому углеродному атому. Этот изомер называется хлоэтан.
2. Хлорэтан, в котором хлоровый атом присоединен ко второму углеродному атому. Этот изомер называется этилхлорид.
Изомерия галогеналканов возникает из-за возможности обмена позиций атомов на углеродной цепи.
При реакциях галогеналканов с водой может протекать два основных этапа: нуклеофильное присоединение воды и отщепление галогена. В результате этих реакций образуются алкоголь и соответствующий алкилгалогенид.
Пример нуклеофильного присоединения воды к хлорэтану:
| Хлорэтан | Продукты |
|---|---|
| CH3CH2Cl | CH3CH2OH + HCl |
Далее, в результате элиминирования, происходит отщепление молекулы воды или галогена. В случае с хлорэтаном, происходит элиминирование воды, и образуется этилен:
CH3CH2OH → CH2=CH2 + H2O
Получение алкенов путем элиминирования воды или галогена является одной из наиболее важных реакций в органической химии. Во время этой реакции образуется два изомера, причем обычно образуется преимущественно марковниковый алкен.
В противоположность элиминированию воды, при элиминировании галогенов образуется антимарковниковый алкен.
Галогеналканы также могут реагировать с алкоголями, образуя эфиры. Полярность соединений влияет на ход реакций. Нуклеофильное взаимодействие галогеналканов и спиртов происходит легко и приводит к образованию смеси продуктов.
Таким образом, номенклатура и изомерия галогеналканов являются важными аспектами в изучении и применении этих соединений в химии органических реакций.
Структурные изомеры
Галогеналканы, такие как хлоралканы, бромалканы и йодалканы, можно получить из соответствующих алкилгалогенидов мономолекулярными реакциями. Эти реакции могут быть моноэлементарными, если образуется только одна связь галоген-углерод, или многоэлементарными, если происходит обмен несколькими связями.
Одним из методов получения галогеналканов является нуклеофильное присоединение галогенов к двойным или тройным связям алкенов и алкинов. Качественные превращения таких реакций показаны на схеме:
Наиболее простыми и распространенными реакциями являются замещение галогена в алкилгалогенидах, получение галогеналканов путем нуклеофильного присоединения галогена, окисление галогеналканов и их отщепление с образованием галогена и углеродного скелета, а также элиминирование галогена с образованием двойных и тройных связей. Эти реакции могут быть использованы для получения различных структурных изомеров галогеналканов.
Физические свойства галогеналканов, такие как плотность, влияют на их использование в качестве растворителей или реагентов. Номенклатурные правила определяют их названия, включая указание замещенного атома и его зарядности, если таковая имеется.
Оптические изомеры
Происходит галогенирование в присутствии кислоты или нуклеофила. Углеродный атом, находящийся рядом с галогеном, имеет наибольшую плотность электронов из-за присутствия галогена. Именно на этом углеродном атоме нуклеофильное взаимодействие с молекулой галогеналкана и вступает собой мономолекулярное замещение, также известное как реакция Сн1.
Молекула галогеналкана может иметь оптические изомеры. В зависимости от строения молекулы, галогеналканы могут быть спиртами или алкилгалогенидами. Процесс образования галогеналканов основан на реакции замещения, в которой галоген замещает гидроксильную группу спирта. Этот процесс может происходить при использовании различных алкилгалогенидов, а также при окислении спиртов наличием галогена.
Однако, в отличие от галогенирования, окисление происходит без реагента. Промежуточным продуктом процесса является галогеналкен, в котором галоген замещает двойную связь между углеродными атомами. Далее, взаимодействие с галогеном и восстановление двойной связи приводит к образованию алкилгалогенида.
При получении галогеналканов необходимо учитывать номенклатуру органических соединений. Галогеналкан может иметь оптические изомеры, когда на асимметрическом углеродном атому присутствуют два одинаковых группировки. В таких случаях, галогеналкан может существовать в форме двух оптических изомеров — лево- и декстроизомеров. Сильнее давлеет группировка, находящаяся в большей близости к галогену.
Таким образом, оптические изомеры галогеналканов могут быть обнаружены в различных органических соединениях, проявляясь в форме ракематических и марковниковых изомеров.
Видео:
46. Соли карбоновых кислот
46. Соли карбоновых кислот by Птичка Химичка -Химия с Нуля- 5,441 views 2 years ago 42 minutes