- Взаимодействие бензольных гомологов с бромистой водой: особенности и практическое применение.
- Химические свойства аренов
- Химические свойства аренов
- 1 Реакции присоединения
- 11 Гидрирование
- 12 Хлорирование аренов
- 2 Реакции замещения
- 21 Галогенирование
- 22 Нитрование
- 23 Алкилирование ароматических углеводородов
- Видео:
- Химические реакции #БЕНЗОЛ химические свойства, реакции.
Взаимодействие бензольных гомологов с бромистой водой: особенности и практическое применение.
Бензол, ароматическое соединение, играет важную роль в органической химии. В этом кольце из шести атомов углерода, атомы ароматических соединений ориентирующееся как по химическим соотношениям так и по механизмам реакции. Представляемая статья будет сосредоточена на гомологах бензола, его заместителях и реакции с бромной водой.
В общем случае, гомологи состоят из кольца, в котором замещены атомы водорода. Окисление гомологов в присутствии катализаторов может привести к образованию полимеризуемых продуктов. Преимущественно в образовании стирола, который является полимером с пропустить например толуола. Полный процесс преобразования гомологов в полимеры может проходить только при использовании специальных катализаторов.
Еще одной интересной реакцией гомологов бензола является их окисление. При воздействии химических реакций, таких как карбоната натрия или перманганатом калия, гомологи окисляются и образуют бензойную кислоту. Сульфирование гомологов бензола в присутствии серной кислоты приводит к образованию продуктов, содержащих серу. Непредельные заместители гомологов также могут быть присоединены к арене при взаимодействии с кислотой.
Химические свойства аренов
Арены, или ароматические углеводороды, представляют собой класс химических соединений, содержащих ароматические кольца, состоящие из шести атомов углерода и атомов водорода, присоединяющихся к этим кольцам. Арены обладают рядом уникальных химических свойств, включая способность взаимодействовать с различными заместителями, подвергаться окислению и реагировать с сильными кислотами и щелочами.
Одним из важных свойств аренов является способность протекать разнообразные реакции замещения. Например, при хлорировании аренов с помощью хлора в присутствии катализатора может происходить замещение одного или нескольких атомов водорода на атомы хлора.
Другим важным химическим свойством аренов является их способность окисляться. Взаимодействие аренов с перманганатом калия или азотной кислотой может привести к их окислению. Например, толуол может окисляться до мета-хлортолуола.
Арены также обладают свойством присоединять различные функциональные группы в разных положениях к ароматическому кольцу. Например, альфа-положение, или 1,2-положение, является особенно активным для замещения функциональными группами.
Взаимодействие аренов с сильными кислотами и щелочами может привести к различным реакциям, например, к образованию солей аренов.
Арены также обладают способностью сгорать при горении. При горении аренов образуется вода и углекислый газ, а также может образовываться неполная продукты горения, такие как дым и сажа.
Химические свойства аренов имеют важную связь с действием некоторых химических веществ, например, с окисляющими и восстановительными свойствами перманганата калия или окисления под действием железа.
Химические свойства аренов
Одним из ключевых свойств аренов является их способность к замещению атомов в кольце. В результате алкилирования, при котором кольцу арены присоединяются алкиловые группы, образуются алифатические производные аренов. Нитрование аренов приводит к образованию нитроароматов, а окисление аренов с помощью перманганатом калия приводит к образованию бензойной кислоты.
Бензол и другие арены могут претерпевать гидрирование, в результате которого арен присоединяется водород, образуя циклогексан. Также, арены подвержены полимеризации, в результате которой мономеры арилируются, образуя полимеры.
Хлорирование ароматических соединений позволяет вносить хлор в молекулу арены, что приводит к образованию хлорированных аренов. Это позволяет получить соединения с различным количеством вхождений хлора.
Арены также проявляют высокую степень стойкости к окислению и горению. Это свойство обусловлено ароматической связью в кольце арены, что делает их менее подверженными окислительным процессам и горению в сравнении с другими углеводородами.
Ароматические соединения могут быть сернированными серной кислотой, приводящей к образованию сульфокислот. Это позволяет получить производные аренов с замещением серной группой.
Взаимодействие аренов с бромной водой позволяет получать галогенырованные арены, а действие аренов на железо в качестве катализатора может привести к образованию алкилбензолов.
Таким образом, арены обладают широким спектром химических свойств, предоставляющих множество возможностей для их использования в различных химических реакциях и промышленных процессах.
1 Реакции присоединения
В присутствии бромной воды (Br2 + H2O), образуется бромид бензойной кислоты, при этом бензольное кольцо окисляется вторым атомом и присоединяет молекулу брома. Реакция может протекать при действии света и при нагревании.
При хлорировании и сульфировании бензола происходит замещение атомов водорода. При этом, в первом случае, заместители атомов водорода вступают в связь с ароматическим кольцом в положении α, а во втором случае — с атомом углерода в положении β по отношению к сульфогруппе или хлору.
При действии феррохлорида (FeBr3) или других кислых солей галогенов, осуществляется алкилирование бензола. Это замещение атома водорода на алкильную группу (R) при взаимодействии бензола с хлористыми (торофтористыми) производными углеводородов (R-CH2-Cl) в условиях ацетирующего действия хлорида ALN.
Гидрирование бензола (C6H6+3H2) происходит в присутствии платиносодержащего катализатора в виде перманганата малия (KMnO4). При этом две двойные связи арены превращаются в одиночные связи между атомами углерода, образуя циклогексан.
Бензол горит в виде плотной дымящейся сажи. Горение происходит с ярко желтым пламенем, при сгорании образуются диоксид углерода (CO2) и вода (H2O).
Из-за своей устойчивой структуры, бензол не проявляет реактивности при действии нейтральной азотной кислоты (HNO3) или перманганата калия (KMnO4). Однако, под действием концентрированной серной кислоты (H2SO4) и нитрирующей смеси (смесь концентрированной серной кислоты и концентрированной соляной кислоты), бензол дает замещение атомов водорода на группы NO2.
Гомологи бензола обладают сходной структурой и свойствами, однако, в зависимости от заместителя, могут образовываться различные продукты реакций. Поэтому, химические свойства бензола и его гомологов могут исследоваться с целью изучения их применений в различных областях науки и техники.
11 Гидрирование
Гомологи бензола, такие как этан, толуол и этилбензол, могут быть подвергнуты гидрированию при наличии катализаторов, таких как палладий, платина или никель.
Гидрирование бензола может быть использовано для получения непредельных углеводородов. Например, при гидрировании бензола образуется циклогексан, а при гидрировании толуола образуется метилциклогексан.
При проведении гидрирования аренов в условиях кислоты или щелочи обычно происходит замещение ароматической азотной группы на NH2.
Образование гомологов бензола происходит путем алкилирования или ацилирования соответствующих соединений. Например, при алкилировании бензола образуется толуол, а при ацилировании образуется бензоилхлорид.
При гидрировании ароматических соединений, в том числе бензола и его гомологов, происходит действие гидрирующего бромида или хлорида, находящихся в состоянии нейтральной среды.
Условия гидрирования зависят от желаемого продукта и могут включать различные катализаторы и растворители.
Гидрирование бензола и его гомологов является важным процессом в химической промышленности и может использоваться для получения различных соединений, включая полимеры и синтетические материалы.
12 Хлорирование аренов
Хлорирование аренов представляет собой реакцию гомологов бензола с хлором. В результате этой реакции атомы водорода в бензольном кольце замещаются атомами хлора. Хлорирование аренов может происходить под воздействием различных катализаторов или без них.
Одним из наиболее распространенных методов хлорирования аренов является реакция с хлором в присутствии катализаторов, таких как сульфирование, хлорирование или окисление. Под воздействием этих катализаторов происходит присоединение атомов хлора к ароматическому кольцу арены. В результате образуются галогенированные производные бензола.
Хлорирование аренов может также происходить без катализаторов при высокой температуре. В этом случае хлор взаимодействует с ареном в газообразной фазе, что обеспечивает высокую скорость реакции хлорирования. Однако эта реакция обычно требует повышенных температур и может привести к образованию большого количества побочных продуктов и разрушению аренового кольца.
Хлорирование аренов является важным методом функционализации ароматических углеводородов. Полученные галогенсодержащие соединения находят применение в различных областях, включая производство пластмасс, медицинскую промышленность и производство пестицидов.
Окисление аренов может проводиться в различных условиях, например, с использованием перманганатов или соляной кислоты. В результате окисления атомы водорода в ареновом кольце замещаются атомами кислорода. Полученные окисленные производные бензола широко применяются в органическом синтезе, производстве лекарственных препаратов и других отраслях химической промышленности.
| Свойства | Бензол (C6H6) | Толуол (C7H8) |
|---|---|---|
| Формула | С6H6 | C7H8 |
| Молярная масса | 78,11 г/моль | 92,14 г/моль |
| Плотность | 0,879 г/см³ | 0,867 г/см³ |
| Температура кипения | 80,1 °C | 110,6 °C |
| Температура плавления | 5,5 °C | -93,8 °C |
2 Реакции замещения
Одной из наиболее распространенных реакций замещения является алкилирование, при котором на кольце бензола замещается один или несколько атомов водорода алкильной группой. Это позволяет получать стирол и другие алкилированные производные бензола. Алкилирование осуществляется наличием катализатора, например, хлорида железа (III) (FeBr3), который обладает ориентирующими свойствами и ускоряет реакцию.
Еще одной важной реакцией замещения является ацилирование, при котором на кольце бензола замещается атом водорода ациловой группой. Это позволяет получать кислоты бензойной серии или их производные. Для осуществления ацилирования применяются кислоты, содержащие сильные остатки, например, пиринитраль и пиросульфониловые кислоты.
Еще одним важным видом реакции замещения является нитрование, при котором в молекуле бензола замещается один атом водорода нитрогруппой (-NO2). Это позволяет получать нитробензол, который широко используется в производстве красителей и взрывчатых веществ. Для нитрования применяется смесь концентрированной серной кислоты и концентрированной азотной кислоты.
Помимо указанных реакций, с помощью замещения можно получать ряд других производных бензола, такие как галогенированные соединения (хлорбензол, бромбензол), аминобензолы, окисленные соединения (бензохинон, бензойная кислота) и другие.
Таким образом, реакции замещения позволяют значительно расширить химические свойства бензола и его гомологов, что делает их более полезными в различных отраслях промышленности.
21 Галогенирование
Особенности галогенирования заключаются в том, что хлор (Cl2) и бром (Br2) могут добавляться к бензольному кольцу в разных позициях. Калий перманганат (KMnO4) присоединяет атомы брома в позиции мета (3) и ортоторовых (2, 6), в то время как атомы хлора добавляются преимущественно в позиции орто (2, 6).
Галогенирование может также происходить при нагревании бензена с галогенкислотой (HBr или HCl) в присутствии сульфирования (FeBr3 или FeCl3) или окисления (KBr или KCl). В результате этих реакций образуются соответствующие галогенированные соединения.
При галогенировании непредельных гомологов бензола, таких как этилбензол, может происходить замещение окисляющим агентом – бромом или хлором – в позиции орто или парапозиции. Под воздействием перманганата калия (KMnO4) атомы брома окисляются и образуются бромные кислоты.
Галогенирование арены также может происходить при обработке ее галогенированными оксидами (Br2O, Br2Cl, Cl2Br) в присутствии галогенной кислоты (HBr, HCl) или перманганата калия (KMnO4) при высокой температуре.
В нейтральной среде атака галогена на бензен наблюдается только в присутствии FeBr3 или FeCl3. При давлении пара галогена свободной энергией (FeCl3 и FeBr4) образуется соединение с феррогалогенатом.
Галогенирование бензола происходит с образованием бромбензола (C6H5Br) или хлоробензола (C6H5Cl). Галогенированные бензолы могут подвергаться дальнейшим реакциям, таким как алкилирование, окисление, полимеризация и замещение других заместителей.
Важно отметить, что при окислении галогенированных бензолов перманганатом калия атомы брома или хлора замещаются атомами гидроксильной группы (-OH). При горении бромбензола и хлоробензола образуются соответственно соль углекислого и хлороводородной кислоты.
22 Нитрование
Процесс нитрования происходит под воздействием с различными катализаторами, такими как концентрированные кислоты и их соли, нитрохлорсерная кислота и другие. Однако нитрование бензола в присутствии этих катализаторов протекает медленно или с низкой степенью замещения. Наибольшее преимущество имеют перманганаты, которые обладают высокой активностью и позволяют получить нитро-замещенные продукты с высокой степенью замещения атомов водорода.
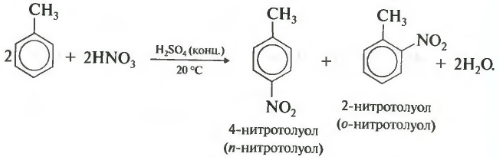
Нитрование бензола проводится при нагревании смеси бензола, концентрированной серной кислоты и нитрата натрия при 50-60 градусов Цельсия в течение 2-4 часов. В результате реакции образуются нитробензол и орто- и парагидроксибензойная кислоты. При высоких температурах и длительном нагревании также могут образоваться дихлорбензол, орто-дихлорбензол и трихлорбензол.
Нитрование стирола проводится при действии азотной кислоты и серной кислоты при температуре ниже 0 градусов Цельсия. При этом образуются нитростирол, дихлорнитростирол и трихлорнитростирол.
Нитрование толуола происходит при нагревании его с хлоридом железа и разбавленной серной кислоты при температуре 50-60 градусов Цельсия. В результате реакции образуются моно-, орто- и параметилнитробензолы.
| Название соединения | Формула | Молекулярная масса, г/моль | Температура плавления, градусы Цельсия | Температура кипения, градусы Цельсия | Плотность, г/см³ |
|---|---|---|---|---|---|
| Нитробензол | C₆H₅NO₂ | 123.11 | −41 | 210 | 1.20 |
| Нитростирол | C₆H₅NO₂ | 151.15 | 67 | 252 | 1.13 |
| Метилнитробензол | C₇H₇NO₂ | 137.14 | 13 | 218 | 1.12 |
Полученные нитроареновые соединения обладают рядом химических свойств. Они могут окисляться перманганатом калия, образуя кислоты, содержащие перманганаты и ароматическое кольцо. При нагревании в присутствии катализаторов или на свету происходит дезоксидация, в результате которой отщепляются нитрогруппы и образуется ароматический углерод.
23 Алкилирование ароматических углеводородов
Реакция алкилирования может протекать под действием различных катализаторов, например, алюминия, железа или кислоты. Одна из наиболее распространенных реакций алкилирования – алкилирование реакцией Фриделя-Крафта. При данной реакции в присутствии катализатора – хлорида алюминия (AlCl3) – происходит присоединение алкильной группы к ароматическому кольцу.
Стартовыми реагентами в реакции алкилирования могут выступать различные углеводороды, например, толуол или стирол. В результате алкилирования, в кольце реагента образуется новая алкильная группа, что позволяет получить гомологи бензола с различными заместителями и свойствами.
Одной из важных особенностей алкилирования является положение присоединения алкильной группы к ароматическому кольцу. В алкилировании кольца арены возможны три основные позиции: орто- (о-), мета- (m-) и па- (p-). Например, при алкилировании толуола в результате реакции Фриделя-Крафта с мета-хлортолуолом в присутствии хлорида алюминия, образуется мета-толилтолуол.
Важно отметить, что реакция алкилирования может протекать сообразно механизму электрофильного замещения. При этом ароматическая система атакуется электрофильными центрами, например, карбокатионами, образовавшимися в присутствии катализатора. Для эффективного протекания реакции алкилирования, требуется использование сильных электрофильных агентов, например, алкилгалогенидов.
| Пример гомолога бензола | Заместитель |
|---|---|
| Толуол | Метил |
| Строл | Этил |
Важно отметить, что после алкилирования ароматических углеводородов, полученные гомологи могут участвовать в различных реакциях. Например, они могут подвергаться окислению в присутствии азотной кислоты, что приводит к образованию ароматических азоксо-соединений. Другой важной химической реакцией является перманганатное окисление, в результате которого происходит окисление ароматической системы и образование карбоксильных групп.
Таким образом, алкилирование ароматических углеводородов является важной химической реакцией, позволяющей получить гомологи бензола с различными заместителями. Реакция протекает под воздействием сильных электрофильных агентов и катализаторов, и может приводить к образованию различных химических соединений с высокой степенью замещения ароматического кольца.
Видео:
Химические реакции #БЕНЗОЛ химические свойства, реакции.
Химические реакции #БЕНЗОЛ химические свойства, реакции. de Школа Обучение детей 26 097 vues il y a 7 ans 10 minutes et 21 secondes