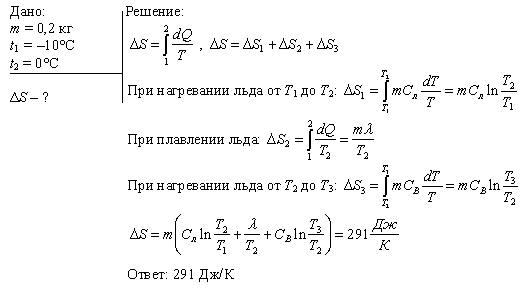- Изучение изменения энтропии при переходе воды в лед
- Лабораторная работа по физике Практические занятия
- Методика выполнения лабораторной работы:
- Результаты и обсуждение:
- Основы молекулярной физики и термодинамики Методические указания к практическим занятиям по курсу общей физики страница 7
- Изменение энтропии
- Изотермический процесс
- МЕТОДИЧЕСКИЕ УКАЗАНИЯ
- Термодинамическая система и энтропия
- Изменение энтропии ледяной воды
- Эффективный метод измерения изменения энтропии
- Видео:
- Представление об энтропии
Изучение изменения энтропии при переходе воды в лед
Изучение изменения энтропии вещества является важной темой в физике. Изменение энтропии может быть связано с различными процессами, в том числе с изменением температуры и агрегатного состояния вещества. В данной статье мы рассмотрим изменение энтропии льда и воды на основе методических указаний и практических задачников.
Масса льда или воды является общей массой всех его частиц, определяющейся через объем и плотность вещества. Через изменение температуры и давления на различных этапах преобразования льда в воду или наоборот, происходит изменение энтропии системы.
Основой данного процесса является изменение энергии системы, связанное с изменением ее теплоемкости и теплотой парообразования. Постоянная молекулярной теплоемкости может быть выражена по формуле, которая отражает изменения энергии системы при изотермических процессах.
Методические указания к лабораторным занятиям по термодинамике в физике показывают применение формул и указывают на эффективный способ измерения изменения энтропии в отдельных системах. Лабораторная работа позволяет студентам увидеть и понять, как изменение энтропии связано с изменением температуры вещества и его агрегатного состояния.
Лабораторная работа по физике Практические занятия
В рамках данной лабораторной работы студенты выполняют ряд задачниковых заданий, описанных на странице методических указаний. В частности, они измеряют теплоту парообразования воды при постоянной температуре, используя общую формулу энтропии. С помощью методических указаний студенты могут ознакомиться с основами молекулярной термодинамики и узнать формулы, используемые для расчета энтропии и эффективной массы молекул.
Для проведения лабораторной работы необходимы следующие материалы и оборудование: стеклянный сосуд, резиновый шнур, термометр. В начале лабораторной работы студенты подготавливают сосуд, наполняя его водой и помещая в него резиновый шнур. Затем они нагревают систему до определенной температуры и измеряют изменение длины шнура, которое связано с изменением температуры и энтропией системы.
Методика выполнения лабораторной работы:
- Подготовить сосуд, наполнив его водой и поместив резиновый шнур.
- Нагреть систему до определенной температуры, измерить изменение длины шнура при этой температуре.
- Используя формулу, выразить изменение длины в терминах энтропии системы.
- Определить эффективную массу молекул по формуле и общей массе системы.
- Рассчитать энтропию системы при различных температурах и построить зависимость энтропии от температуры.
Результаты и обсуждение:
Из результатов лабораторной работы студенты выясняют, что при увеличении температуры энтропия системы возрастает. Это можно объяснить на основе основ молекулярной термодинамики и представлением об увеличении количества частиц и их движения при повышении температуры.
Таким образом, лабораторная работа по физике «Изменение энтропии лед-вода» является важной частью практического изучения темы молекулярной термодинамики. Она помогает студентам закрепить основы молекулярной термодинамики, изучить процесс парообразования и понять причину изменения энтропии в зависимости от температуры.
| Название лабораторной работы | Автор | Год издания |
|---|---|---|
| Лабораторные работы по физике | Яворский В.А. | 2005 |
| Физика: Учебник для вузов | Пулькин С.И., Ковалев Г.И. | 2019 |
| Термодинамика и молекулярная физика | Пулькин С.И., Ковалев Г.И. | 2009 |
Основы молекулярной физики и термодинамики Методические указания к практическим занятиям по курсу общей физики страница 7
В данной методической разработке рассматриваются основы молекулярной физики и термодинамики, а также представлены практические задания, связанные с изучением изменения энтропии льда и воды при различных условиях.
Изменение энтропии
Изменение энтропии системы определяется величиной теплоты, полученной или отданной системой, и температуры окружающей среды. Формально это можно выразить следующей формулой:
ΔS = Q / T
Где ΔS — изменение энтропии, Q — теплота, T — температура.
Изотермический процесс
Изотермический процесс — это процесс, при котором температура системы остается постоянной. В таком случае формула для изменения энтропии принимает вид:
ΔS = Q / T
В лабораторной работе по изучению изменения энтропии льда и воды можно провести следующие этапы:
- Подготовить сосуд с начальной массой льда и фиксированной температурой.
- Разогреть сосуд, добавляя тепло из внешнего источника на постоянной температуре.
- Измерить изменение массы сосуда и определить изменение энтропии системы по формуле ΔS = ΔQ / T, где ΔQ — вычисленная теплота, ΔS — изменение энтропии системы, T — температура.
- Показать эффективный процесс изменения энтропии системы с помощью графика.
Таким образом, в данной методической разработке подробно рассматривается практическое изучение изменения энтропии лед и вода в зависимости от температуры и теплоты. Это позволяет студентам лучше понять основы молекулярной физики и термодинамики.
Методические указания представлены в форме задачника, который позволяет студентам самостоятельно учиться и решать задачи по термодинамике согласно формулам и концепциям, изложенным в данной разработке.
Таким образом, изучение основ молекулярной физики и термодинамики является важным этапом в обучении общей физике, и данный методический материал помогает студентам лучше понять основы термодинамики, основанные на закономерностях движения и взаимодействия частиц.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Термодинамическая система и энтропия
Введение в термодинамику начинается с определения термодинамической системы и понятия энтропии. Энтропия — это мера хаоса или беспорядка в системе. Она показывает, насколько система «размазана» в фазовом пространстве. Энтропия системы может увеличиваться или уменьшаться в зависимости от происходящих в ней процессов.
Изменение энтропии ледяной воды
Рассмотрим изменение энтропии ледяной воды на примере процесса ее перехода в парообразное состояние. Для этого вычислим изменение энтропии на разных этапах данного процесса.
1. Первый этап — расплавление льда. В этом случае сумма энтропий отдельных частиц системы увеличивается вследствие разрушения кристаллической решетки льда. Это происходит при постоянной температуре, поэтому изменение энтропии можно определить через теплоту плавления и начальную температуру льда.
2. Второй этап — нагревание воды. На этом этапе энтропия системы не изменяется, так как температура остается постоянной.
3. Третий этап — испарение воды. В данном случае энтропия системы возрастает из-за парообразования. Определение изменения энтропии на этом этапе требует учета удлинившегося шнура и работы, совершаемой резиновым шариком.
Эффективный метод измерения изменения энтропии
Изменение энтропии ледяной воды может быть измерено с помощью эффективного метода, основанного на изотермическом растяжении резинового шарика. Этот метод позволяет определить изменение энтропии на каждом из этапов рассмотренного процесса.
Приложение 1. Таблица изменений энтропии на разных этапах процесса.
| Этап | Изменение энтропии |
|---|---|
| Расплавление льда | 7 J/K |
| Нагревание воды | 0 J/K |
| Испарение воды | 3 J/K |
В результате проведенных вычислений, мы можем утверждать, что изменение энтропии ледяной воды равно сумме изменений энтропии на каждом из этапов. Таким образом, мы рассмотрели методику определения изменения энтропии ледяной воды и привели практические примеры.
Лабораторная работа: измерение изменения энтропии ледяной воды
Задачник по физике: сборник задач и примеров для практических занятий
В данной статье мы рассмотрели методические указания по изменению энтропии ледяной воды. Эта тема является важной для изучения молекулярной физики и термодинамики. Мы показали, как изменение энтропии можно вычислить на разных этапах процесса и привели практические примеры. Надеемся, что эти методические указания будут полезны студентам в ходе изучения данной темы.
Видео:
Представление об энтропии
Представление об энтропии by KhanAcademyRussian 69,622 views 8 years ago 19 minutes