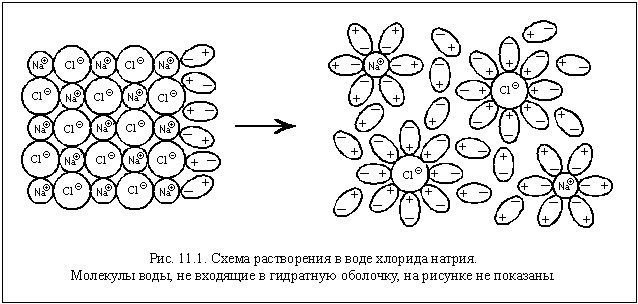
- Как определить, вступает ли вещество в реакцию с водой: Практические методы и исследования
- Урок 28 Химические свойства воды
- Физические свойства воды
- Химические свойства воды
- Взаимодействие с оксидами неметаллов
- Взаимодействие с оксидами металлов
- 1. Взаимодействие металлических оксидов
- 2. Взаимодействие неметаллических оксидов
- Взаимодействие с металлами
- Вода: строение и свойства
- Строение воды
- Свойства воды
- Водореактивные вещества
- Все химические реакции, которые необходимы для успешной сдачи ОГЭ
- Металлы
- Неметаллы
- Правило 11 Взаимодействие простых веществ металлов и неметаллов с водой
- Реакция с магнием:
- Реакция с алюминием:
- Правило 12. Взаимодействие оксидов с водой
- Водореактивные вещества — Water-reactive substances
- Реакция металлов с водой
- Реакция неметаллов с водой
- СОДЕРЖАНИЕ
- Щелочные металлы
- Свойства щелочных металлов
- Таблица: Щелочные металлы и их оксиды
- Щелочноземельные металлы
- Оксиды щелочноземельных металлов
- Активность щелочноземельных металлов
- Видео:
- Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по Химии
Как определить, вступает ли вещество в реакцию с водой: Практические методы и исследования
Реакция веществ с водой – одна из основных химических реакций, которая возникает при взаимодействии различных химических веществ с молекулами воды. Результатом этого взаимодействия образуются гидроксиды, электролитические соли, а также водород и оксид соответствующего металла. Вода является одним из самых распространенных реагирующих веществ в природе, поэтому изучение ее взаимодействия с другими веществами имеет большое значение.
Наиболее известные и химически реагирующие вещества с водой – это щелочные металлы, такие как натрий, калий и литий, которые образуют гидроксиды и выделяются в виде газа или паром, начиная уже при комнатной температуре. Взаимодействие металлов с водой может быть использовано для демонстрации химических реакций в ходе урока по химии, для изучения таблицы элементов или для получения щелочных оснований в химических лабораторных условиях.
Кроме того, вода может реагировать с металлическими оксидами, что приводит к образованию оксидов щелочных металлов. Во время образования гидроксидов или оксидов в процессе взаимодействия оксида с водой, выделяется значительное количество тепла, что делает реакцию живой и зримой.
Урок 28 Химические свойства воды
Физические свойства воды
Вода — прозрачная, безцветная жидкость. Она хорошо растворяет большинство веществ, поэтому часто используется в химических реакциях или в качестве растворителя.
Химические свойства воды
Вода является средой для многих химических реакций. Например, она реагирует с многими металлами, образуя гидроксиды. Поэтому вода может быть использована для определения активности металлов.
Некоторые металлы, такие как бериллий и металлы первой группы, реагируют с водой более активно и образуют гидроксиды, газы и кислоты. Такие металлы называются water-reactive металлами. Но большинство металлов реагируют с водой только при высоких температурах или только с определенными кислотными оксидами.
Вода также реагирует с неметаллами, образуя кислоты. Например, вода и оксиды неметаллов взаимодействуют, образуя кислоты и газы. Поэтому вода может использоваться для определения активности неметаллов.
Химическая реакция между водой и веществом может привести к образованию щелочных или кислотных свойств. Например, реакция с водородом образует щелочные свойства, а реакция с гидроксидом образует кислотные свойства.
Многие вещества обладают способностью реагировать с водой. Например, соли растворяются в воде, образуя ионы. Поэтому вода может использоваться для получения реакционной среды для веществ, которые реагируют с ионами. Также вода может реагировать с некоторыми оксидами, образуя кислоты или основания.
Основание, согласно правилу, является веществом, которое, включая воду, способно образовывать ионы гидроксида в растворе. Кислота, с другой стороны, образуется при взаимодействии с водой и не образует гидроксидные ионы.
Таким образом, вода играет важную роль в химических реакциях, включая реакции с металлами, неметаллами, кислотами, основаниями и другими веществами.
Взаимодействие с оксидами неметаллов
Вода может взаимодействовать с различными химическими веществами, включая оксиды неметаллов. Некоторые из этих веществ, известные как водореагенты (water-reactive substances), могут разлагаться при контакте с водой, образуя щелочные или кислотные растворы.
Оксиды неметаллов – это химические соединения, состоящие из неметаллических элементов и кислорода. Когда вода вступает в реакции с оксидами неметаллов, образуется ряд кислот или оснований.
В различных исследованиях химической реакции воды с оксидами неметаллов, такие как оксид алюминия (Al2O3), оксид бериллия (BeO) и оксид магния (MgO), было установлено, что их взаимодействие с водой происходит при разных температурах. Некоторые оксиды реагируют с водой на холодных температурах, а некоторые – при нагревании.
Например, при взаимодействии оксидов алюминия и бериллия с водой при обычных температурах образуются соответствующие основания – гидрооксиды алюминия (Al(OH)3) и бериллия (Be(OH)2). Такие реакции можно наблюдать, например, во время экспериментов по химии, проводимых при подготовке к ОГЭ.
Кроме того, существуют и другие оксиды неметаллов, в которых взаимодействие с водой происходит бурно и активно. В результате их взаимодействия с водой образуются новые вещества, такие как кислоты или основания. Например, оксид серы (SO2) при взаимодействии с водой образует серную кислоту (H2SO3).
Важно отметить, что для образования оснований во время взаимодействия оксидов неметаллов с водой может потребоваться наличие большого количества воды. Количество образующейся соли, например, магния (Mg(OH)2), будет зависеть от молекулярного веса оксида и его соотношения с водой.
В этом списке приведены некоторые оксиды неметаллов и соответствующие вещества, образующиеся при их взаимодействии с водой:
- Оксид алюминия (Al2O3) – гидрооксид алюминия (Al(OH)3)
- Оксид бериллия (BeO) – гидрооксид бериллия (Be(OH)2)
- Оксид магния (MgO) – гидрооксид магния (Mg(OH)2)
- Оксид серы (SO2) – серная кислота (H2SO3)
Таким образом, взаимодействие воды с оксидами неметаллов является одним из главных свойств этих веществ, и результатом этого взаимодействия могут быть различные химические реакции.
Взаимодействие с оксидами металлов
Например, оксид SiO2 образует кремниевую кислоту Si(OH)4, которая, в свою очередь, прекрасно реагирует с водой:
SiO2 + 2H2O → Si(OH)4
В результате этого взаимодействия образуется кремневая кислота, которая является основанием и образует кислотные соли с соответствующими кислородными кислотами.
Взаимодействие оксидов металлов с водой подразделяется на два основных типа:
1. Взаимодействие металлических оксидов
Многие металлы способны реагировать с холодной водой, образуя простые щелочные растворы и выделяя водород.
Реакция алюминия с водой является самым наиболее ярким и заметным примером такого взаимодействия:
2Al + 6H2O → 2Al(OH)3 + 3H2
В результате этой реакции образуется оксид алюминия, который реагирует с водой и образует основание алюминия. При этом выделяется водород.
2. Взаимодействие неметаллических оксидов
Неметаллы также могут образовывать кислотные растворы, реагируя с водой. Некоторые из них, например, оксид серы (SO2) и оксид азота (NO2), способны образовывать кислоту при простом контакте с водой:
SO2 + H2O → H2SO3
NO2 + H2O → HNO3
Оксид серы образует серную кислоту, а оксид азота образует азотную кислоту. Эти кислоты расположены в ряду с соответствующими кислородными кислотами и являются их производными.
Таким образом, взаимодействие оксидов металлов с водой может протекать с образованием оснований, а взаимодействие неметаллических оксидов — с образованием кислот. Это основное общее свойство ряда металлов и неметаллов.
Взаимодействие с металлами
Взаимодействие металлов с водой может происходить при различных температурах. Например, некоторые металлы, такие как натрий и калий, активно реагируют с холодной водой, образуя основания и выделяя гидроген. Такие реакции соответствуют образованию гидроксидов металлов:
2Na + 2H2O → 2NaOH + H2↑
2K + 2H2O → 2KOH + H2↑
В результате взаимодействия некоторых металлов с водой может образоваться газ, который можно увидеть в виде пузырьков. При этом вода приобретает щелочную реакцию.
Однако не все металлы образуют гидроксиды при взаимодействии с водой. Алюминий и цинк, например, малоактивны при взаимодействии с холодной водой, но могут реагировать с горячей водой или паром:
2Al + 6H2O → Al2O3 +6H2↑
Zn + 2H2O → Zn(OH)2 + H2↑
Также некоторые металлы образуют оксиды при взаимодействии с водой. Например, щелочные металлы образуют оксиды металлов:
2Li + H2O → Li2O + H2↑
2Na + 2H2O → 2NaOH + H2↑
Отличие реакций металлов с водой связано с их способностями сдавать или не сдавать электроны. Сдача электронов происходит при взаимодействии металлов с водой и образовании гидроксидов, а не сдача электронов – при образовании оксидов.
Взаимодействие металлов с водой – важный урок в химии, так как эта тема основана на признании основных закономерностей в химических реакций. Знание этих закономерностей необходимо для успешной сдачи ОГЭ по химии, так как в данном варианте экзамена присутствуют задания на определение веществ по их взаимодействию с водой.
Взаимодействие металлов с водой очень интересно и полезно для знания человека. Металлы позволяют не только производить множество нужных вещей, но и демонстрировать поразительные свойства при взаимодействии с другими веществами.
Вода: строение и свойства
Строение воды
Структура воды обусловлена ее полярностью. Молекула воды имеет несимметричную форму, где ближайшие атомы водорода и кислорода отличаются по заряду. Кислородный атом притягивает электроны сильнее, образуя отрицательную часть молекулы, а водородные атомы получают положительный заряд.
Комбинация этих положительных и отрицательных зарядов позволяет молекулам воды образовывать водородные связи, благодаря которым они могут образовывать кластеры и создавать множество взаимодействий с другими веществами.
Свойства воды
Основные свойства воды включают:
- Высокую теплоемкость и теплопроводность;
- Высокую поверхностное натяжение;
- Кристаллическую структуру при замерзании, обеспечивающую плавание льда на поверхности воды;
- Хорошую растворимость для многих веществ.
Вода также обладает амфотерными свойствами, что означает, что она может реагировать и с кислотами, и с щелочами. Это связано с ее способностью диссоциировать на ионы гидроксида OH- и ионы водорода H+, которые могут принимать участие в различных химических реакциях.
Один из существенных уроков изучения химии связан с водой и ее способностями взаимодействовать с различными веществами. Например, щелочные и щелочноземельные металлы образуют гидроксиды при реакции с водой, тогда как неметаллы образуют кислоты либо оксиды. В воде растворяются многие соли, образуя ионы, также происходят различные химические реакции.
Водореактивные вещества
В природе существуют вещества, которые сильно реагируют с водой. Они называются водореактивными или water-reactive веществами. Бурная реакция, возникающая при взаимодействии таких веществ с водой, может быть опасной и требует особой осторожности.
Металлы являются примером веществ, реагирующих с водой. Взаимодействие металлов с водой может приводить к образованию гидроксидов простых металлов, а также выделению водорода. Вода также может реагировать с некоторыми неметаллами и образовывать оксиды и водородные соединения.
Изучение реакций металлов с водой важно для понимания их химических свойств и возможных применений. Оно помогает классифицировать металлы как реагирующие и нереагирующие с водой и установить их реакционную способность. Ряд металлов образует соединения с водородом, включая алюминий и некоторые щелочно-земельные металлы.
Вода — одно из самых важных веществ в химии и ее изучение помогает понять ряд химических процессов, связанных с водореактивными веществами и реакцией металлов с водой.
Все химические реакции, которые необходимы для успешной сдачи ОГЭ
Металлы
Многие металлы являются водореактивными, то есть они реагируют с водой при образовании газа и соответствующих гидроксидов или оксидов. В результате такой реакции образуются газы, вызывая характерные явления, такие как пузыри и плавающие металлические кусочки на поверхности воды. Некоторые образующиеся гидроксиды металлов являются щелочными.
Например, натрий (Na) является металлом, который реагирует с водой по следующему уравнению:
2Na + 2H2O → 2NaOH + H2
Из образующихся в результате реакции гидроксидов металлов особенно важны бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr) и барий (Ba). Эти щелочноземельные металлы образуют сильные щелочи, которые находят широкое применение в промышленности и в быту.
Неметаллы
Некоторые неметаллы также могут реагировать с водой или паром, образуя оксиды или кислоты, в зависимости от условий реакции. Например, при взаимодействии с кислородом, неметалл сероводород (H2S) окисляется до серы (S), а вода превращается в кислоту:
2H2S + O2 → 2S + 2H2O
Такие реакции с неметаллами отличаются от реакций с металлами, поскольку образующиеся продукты могут иметь кислотные свойства.
В ходе изучения химии и подготовки к ОГЭ ученикам важно знать эти химические реакции и соответствующие уравнения реакций, чтобы успешно ответить на вопросы, связанные с этими процессами.
Правило 11 Взаимодействие простых веществ металлов и неметаллов с водой
Химическая реакция между веществами металлов и водой может происходить при различных температурах. Стоит отметить, что взаимодействие осуществляется активными металлами, которые расположены в таблице активности металлов выше водорода.
В результате реакции простого вещества с водой, происходит разложение воды на гидроксид (основание) и оксид металла вместе с образованием газа. Такие реакции можно представить в виде уравнений, например:
Реакция с магнием:
2Mg + 2H2O → 2Mg(OH)2 + H2↑
Реакция с алюминием:
2Al + 6H2O → 2Al(OH)3 + 3H2↑
Получившиеся в результате реакции гидроксиды металлов растворяются в воде, образуя соли, а газ выделяется в виде пузырьков. Отличие реакций простых веществ металлов и неметаллов с водой от реакций с кислотами заключается в том, что в реакционной смеси с кислотами образуется только соль и выделяется вода, а взаимодействие с водой приводит к образованию гидроксидов металлов.
Таким образом, правило 11 для взаимодействия веществ металлов и неметаллов с водой дает полное представление о свойствах данных веществ и помогает студентам химии лучше понять эти процессы.
Правило 12. Взаимодействие оксидов с водой
| Оксид | Химическое уравнение реакции | Образование | Свойства образующихся веществ |
|---|---|---|---|
| Активные металлы (например, Na, K) | X2O + H2O → 2XOH | Гидроксид металла (NaOH, KOH) | Щелочное вещество |
| Щелочноземельные металлы (например, Ca, Mg) | XO + H2O → X(OH)2 | Гидроксид (Ca(OH)2, Mg(OH)2) | Щелочноземельное основание |
| Неметаллы (например, С, Si) | XO2 + H2O → X(OH)4 | Гидроксид (например, Si(OH)4) | Kислотное вещество |
При взаимодействии оксидов с водой образуется соответствующий гидроксид, который может быть как кислотным веществом, так и щелочным — в зависимости от свойств взаимодействующих составляющих. Например, активные металлы (например, Na, K) образуют гидроксиды, которые являются щелочными веществами, так как они растворяются в воде, освобождая гидроксидные ионы (OH-).
Реакции взаимодействия оксидов с водой могут быть химические, например, образование гидроксида, или же физические, например, образование пара.
Необходимо отметить, что не все оксиды взаимодействуют с водой. Некоторые оксиды, например, SiO2 (кремниевый диоксид), не реагируют с водой в нормальных условиях.
Таким образом, взаимодействие оксидов с водой является важным химическим процессом, который приводит к образованию новых веществ с различными свойствами — щелочного или кислотного характера, а также образованию пара при кипячении.
Водореактивные вещества — Water-reactive substances
Водореактивные вещества могут быть различной природы — от металлов до неметаллов. Самый известный пример водореактивного металла — это натрий. При контакте с водой натрий выделяет бурную реакцию, со слизью и выделением газа в результате образуется гидроксид натрия (NaOH).
Металлы, расположенные в щелочноземельных металлах, такие как бериллий, также проявляют активное взаимодействие с водой. В результате образуется гидроксид металла и выделяется газ. Например, бериллий при взаимодействии с водой образует гидроксид бериллия (Be(OH)2) и выделяет гидроген (H2).
У основных неметаллов также есть способность разлагаться в воде. Например, оксидные вещества, такие как SiO2 (двуокись кремния), реагируют с водой, образуя раствор кремнекислоты (H2SiO3).
Реакция металлов с водой
Взаимодействие металлов с водой регулируется их химической активностью и степенью окисления. В таблице ниже приведены некоторые реакции металлов с водой:
- Натрий (Na) + вода (H2O) → гидроксид натрия (NaOH) + гидроген (H2)
- Калий (K) + вода (H2O) → гидроксид калия (KOH) + гидроген (H2)
- Магний (Mg) + вода (H2O) → гидроксид магния (Mg(OH)2) + гидроген (H2)
- Алюминий (Al) + вода (H2O) → гидроксид алюминия (Al(OH)3) + гидроген (H2)
Реакция неметаллов с водой
Неметаллы, такие как кислород, хлор и фтор, реагируют с водой в зависимости от их химической активности. Например, хлор при взаимодействии с водой образует гипохлорит натрия (NaOCl), который является активным окислителем.
Реакции неметаллов с водой могут быть представлены следующим образом:
- Кислород (O2) + вода (H2O) → вода (H2O)
- Хлор (Cl2) + вода (H2O) → гипохлорит натрия (NaOCl)
- Фтор (F2) + вода (H2O) → кислородная кислота (HOF)
Таким образом, водореактивные вещества могут проявлять различную химическую активность при взаимодействии с водой. Изучение их свойств и реакций является важным аспектом в изучении химии и может быть успешно применено на практике при проведении различных химических опытов или уроков.
СОДЕРЖАНИЕ
1. Общее для металлов
2. Водореактивные металлы
3. Реакция металлов с водой
4. Взаимодействие щелочных металлов с водой
5. Реакция щелочноземельных металлов с водой
6. Вода как оксид вещества
7. Образование кислорода при взаимодействии металлов с водой
Щелочные металлы
Металлы, входящие в группу щелочных металлов, включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти металлы проявляют сходные свойства, что делает их классификацию вместе.
При взаимодействии щелочных металлов с водой образуются щелочные гидроксиды и водород. Например, натрий реагирует с водой, образуя гидроксид натрия и водородный газ:
2Na + 2H2O → 2NaOH + H2
Это химическое взаимодействие является одной из характерных реакций щелочных металлов с водой.
Свойства щелочных металлов
Основные свойства щелочных металлов включают высокую активность их оксидов в качестве кислотных оксидов, а также взаимодействие с кислотами.
Взаимодействие щелочных металлов с кислотами приводит к образованию солей и выделению водорода. Например, реакция натрия с кислотой:
2Na + 2HCl → 2NaCl + H2
Взаимодействие щелочных металлов с неметаллами, такими как кислород и сера, образует оксиды. Например, образование оксида натрия:
4Na + O2 → 2Na2O
Таблица: Щелочные металлы и их оксиды
| Металл | Оксид |
|---|---|
| Литий (Li) | Li2O |
| Натрий (Na) | Na2O |
| Калий (K) | K2O |
| Рубидий (Rb) | Rb2O |
| Цезий (Cs) | Cs2O |
| Франций (Fr) | Fr2O |
Таким образом, щелочные металлы обладают химическими свойствами, которые позволяют им реагировать с водой, образуя гидроксиды и водород. Взаимодействие щелочных металлов с другими веществами может приводить к образованию оксидов и солей.
Щелочноземельные металлы
Взаимодействие щелочноземельных металлов с водой является реакционной, в результате которой образуются соответствующие гидроксиды и осадки. Эти реакции химические и происходят по принципу сдачи металлом своего активного водородного атома.
Наиболее активным взаимодействием с водой обладает натрий, вещество, которое используется в качестве учебного примера на уроках химии. В результате реакции натрия с водой образуются гидроксид натрия и водород:
2Na + 2H₂О = 2NaOH + H₂↑
Расположенные в ряду щелочных металлов бериллий и магний в воде не реагируют, а после реагирующие металлы представляют собой металлы средней активности. Самым гидроксида цинка.
Оксиды щелочноземельных металлов
Оксиды щелочноземельных металлов являются оксидной составляющей простых веществ. Все оксиды щелочноземельных металлов, за исключением гидроксидов бериллия и магния, являются оксидами водореактивными, то есть способными к реакциям с паром воды или водой. Реакция оксидов с водой протекает с образованием щелочных растворов соответствующих гидроксидов.
Активность щелочноземельных металлов
Количество щелочноземельных металлов в веществе определяет его активность в реакциях с водой. Чем больше содержание этих металлов в веществе, тем оно более активное во взаимодействии с водой.
В результате взаимодействия щелочноземельных металлов с водой образуется гидроксид металла и выделяется водород. Реакции этих металлов с водой являются одним из основных уроков химии и представляют собой часть общей теории растворов.
Видео:
Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по Химии
Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по Химии de INTENSIVKURS — Учебный Центр для Школьников 314.592 visualizaciones hace 2 años 8 minutos y 48 segundos