- Примеры оксидов, которые не проявляют взаимодействие с водой
- Химические свойства основных оксидов
- Какие оксиды не взаимодействуют с водой примеры
- Все химические реакции, которые необходимы для успешной сдачи ОГЭ
- Правило 11 Взаимодействие простых веществ металлов и неметаллов с водой
- Правило 12 Взаимодействие оксидов с водой
- Уроки по неорганической химии для подготовки к ЕГЭ
- Химические свойства оксидов
- Видео:
- 12-3 Оксиды 0
Примеры оксидов, которые не проявляют взаимодействие с водой
Оксиды — это соединения, состоящие из металла и кислорода. В зависимости от активности металла и условий взаимодействия, оксиды могут проявлять различные свойства. Одним из таких свойств является взаимодействие с водой.
Основными оксидами, которые не взаимодействуют с водой, являются оксиды металлов с очень низкой активностью. Некоторые из них вообще нерастворимы в воде и образуют остаток реакции в виде осадка.
Например, оксид алюминия (Al2O3) не вступает в химическую реакцию с водой при обычных условиях, так как он обладает амфотерными свойствами. Амфотерные оксиды могут взаимодействовать как с кислотными, так и с щелочными средами. Определить амфотерность можно с помощью соответствующего оксидного или водородного показателя рН.
Другим примером оксида, не взаимодействующего с водой, является оксид серы (SO2). Взаимодействие между ним и водой протекает через серу на основе реакции термического окисления и снижая активность серы.
Некоторые оксиды металлов взаимодействуют с водой в присутствии активных карбонатами или солями. Например, оксид натрия (Na2O) взаимодействует с водой, образуя щелочную реакцию и образуя натриевую щелочь NaOH. Термическое воздействие и давление в данном случае необходимы для протекания процесса.
Наиболее активные оксиды металлов, такие как оксид азота (NO2) и оксид хлора (ClO2), взаимодействуют с водой под воздействием высокой температуры и в присутствии активных кислотных или сильных основных сред. Они обладают водоотнимающими свойствами и образуют кислотные или основные ионы.
Таким образом, взаимодействие оксидов с водой зависит от их активности, особенностей структуры, условий протекания процесса и присутствия активных сред. Величина активности оксидов в данном случае определяется реакцией с водой, а также реакцией с кислотными и основными реагентами.
Химические свойства основных оксидов
Основные оксиды — это соединения, которые образуются при взаимодействии щелочных и щелочноземельных металлов с кислородом. Такие оксиды имеют щелочную природу и являются основателями.
Химические свойства основных оксидов включают:
- Способность реагировать с водой для образования гидроксидов. Например, оксид натрия (Na2O) и оксид кальция (CaO) реагируют с водой, образуя гидроксиды NaOH и Ca(OH)2.
- Способность реагировать с кислотами для образования солей. Оксиды щелочных металлов образуют соли, например, оксид натрия (Na2O) реагирует с кислотой соляной (HCl) и образует соль NaCl.
- Способность принимать кислород от других веществ. Они могут служить окислителями, покидая себя и передавая кислород другим веществам. Например, оксиды азота (NO2 и NO) могут окислить углерод соединений, превращая их в угарный газ (CO2).
- Способность восстанавливаться кислородом. Щелочные и щелочноземельные оксиды могут восстанавливаться кислородом до соответствующего металла. Например, оксид кальция (CaO) может быть восстановлен кальцием (Ca).
- Способность реагировать с нерастворимыми веществами, такими как карбонаты. Они образуют с ними нерастворимые соли. Например, оксид кальция (CaO) реагирует с карбонатом кальция (CaCO3) и образует нерастворимую соль — известняк (CaCO3).
Знание химических свойств основных оксидов необходимо для успешной самоподготовки к урокам химии и экзамену по ЕГЭ. Проводятся различные опыты и практические работы с оксидами для изучения и определения их свойств. Такие уроки помогают определить особенности реакций оксидов с кислородом и другими активными веществами. Знание правил реакций с оксидами помогает понять и объяснить, какие оксиды взаимодействуют с водой, кислотами и другими веществами.
Какие оксиды не взаимодействуют с водой примеры
Однако существуют оксиды, которые не взаимодействуют с водой. Это связано с их особенностями и степенью активности. Например, оксид алюминия (Al2O3) не реагирует с водой. Алюминий — металл, поэтому его оксид не является кислотным и не проявляет активность взаимодействия с водой.
Еще одним примером такого оксида является оксид серы (SO2). Он не вступает в прямую реакцию с водой, не образуя кислоты. Однако, в присутствии воздуха и высоких температур он может реагировать с кислородом и образовывать серный трехокись (SO3). Реакция между оксидом серы и водой возможна при наличии катализатора, например, оксида алюминия.
Еще одним примером оксида, который не взаимодействует с водой, является оксид железа, Fe3O4. Он образуется при окислении железа и также не вступает в реакцию с водой.
Оксиды щелочноземельных металлов, таких как MgO (оксид магния) и CaO (оксид кальция), также не реагируют с водой. Они являются основными оксидами и могут реагировать с кислотами, образуя соли и воду.
В целом, взаимодействие оксидов с водой зависит от их активности и химических свойств. Особенности взаимодействия могут быть обусловлены различными факторами, включая структуру оксида, его способность к окислению или восстановлению, а также наличие катализаторов или других химических средств. При самоподготовке к ОГЭ по химии необходимо знать особенности оксидов и их взаимодействие с водой, чтобы успешно справиться с заданиями, связанными с растворами и ионами.
Все химические реакции, которые необходимы для успешной сдачи ОГЭ
Для успешной сдачи ОГЭ по химии необходимо знать различные химические реакции, включая взаимодействие оксидов с водой, разложение угарного газа, восстановление и окисление в реакциях с кислотами и щелочами, а также особенности реакций с основными и щелочноземельными металлами.
Оксиды – это химические соединения, которые образуются при взаимодействии веществ с кислородом, включая кислотные и амфотерные оксиды. Амфотерные оксиды могут взаимодействовать как с кислотами, так и с щелочами. Некоторые оксиды не взаимодействуют с водой, например:
| Названия | Примеры |
|---|---|
| Кислотные оксиды | CO2, P2O5, NO, NO2, N2O5 |
| Основные оксиды | Na2O |
| Щелочноземельные оксиды | Fe3O4 |
Кислотные оксиды образуют кислотный оксид или кислоту при взаимодействии с водой. Амфотерные оксиды могут образовывать и кислоту, и щелочь при взаимодействии с водой, в зависимости от условий реакции. Основные оксиды образуют основные растворы с водой, а щелочноземельные оксиды – нерастворимые основы.
Восстановительные реакции – это реакции, в результате которых происходит передача электронов или восстановление веществ. Некоторые примеры восстановительных реакций, необходимых для успешной сдачи ОГЭ:
- Окисление железа:
- Восстановление кислорода:
Fe + O2 → Fe2O3
2H2O → O2 + 4H+
Разложение угарного газа также является важной реакцией, необходимой для успешной сдачи ОГЭ по химии:
2CO → CO2 + C
Оксиды могут проявлять амфотерные свойства при взаимодействии с водой, например:
- P2O5 + H2O → H3PO4
- ZnO + H2O → Zn(OH)2
Все эти реакции, включая взаимодействие оксидов с водой, разложение угарного газа и восстановление и окисление в реакциях с кислотами и щелочами, являются необходимыми для успешной сдачи ОГЭ по химии. Помимо этого, необходимо знать особенности реакций с основными и щелочноземельными металлами.
Правило 11 Взаимодействие простых веществ металлов и неметаллов с водой
Оксиды металлов и неметаллов обычно взаимодействуют с водой, причем с разной степенью активности. Для некоторых металлов, таких как железо, углерод и медь, взаимодействие с водой происходит с образованием соответствующих кислотообразующих оксидов.
Например, оксид железа (III) (Fe2O3) и оксид углерода (CO), при контакте с водой, происходит реакция образования соответствующей кислоты:
Fe2O3 + 3H2O → Fe(OH)3 + 3H2O
CO + H2O → H2CO3
Однако некоторые оксиды, такие как оксид кальция (CaO) и кремнезем (SiO2), не взаимодействуют с водой.
Взаимодействие металлов с водой зависит от их активности. Например, активные металлы, такие как натрий (Na) и калий (K), реагируют с водой, образуя гидроксиды и выделяя водород:
2Na + 2H2O → 2NaOH + H2
2K + 2H2O → 2KOH + H2
В то же время, менее активные металлы, такие как железо (Fe) и медь (Cu), не взаимодействуют с водой при комнатной температуре.
Взаимодействие неметаллов с водой также может быть различным. Например, обычные неметаллы, такие как кислород (O2) и азот (N2), не взаимодействуют с водой. Однако, некоторые неметаллы могут взаимодействовать с водой при наличии подходящих условий.
Важно знать, что взаимодействие металлов и неметаллов с водой может быть также сильно зависеть от других факторов, таких как концентрация веществ, температура, а также наличие кислот или щелочей.
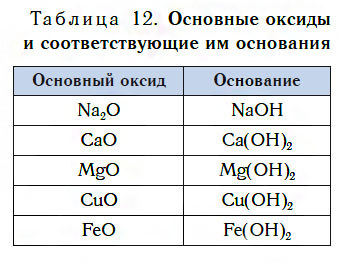
Правило 12 Взаимодействие оксидов с водой
Знание правил взаимодействия оксидов с водой важно для правильного понимания химических реакций и свойств веществ. Правило 12 относится к взаимодействию оксидов щелочных металлов с водой.
Особенности взаимодействия щелочных металлов с водой связаны с их оксидами. Щелочные металлы образуют оксиды, в которых они находятся в самом низком степени окисления (например, Na2O, K2O). Эти оксиды являются основными и взаимодействуют с водой по обычным реакциям восстановления. В результате таких реакций образуются гидроксиды или щелочи – соли оксидов щелочных металлов (например, NaOH, KOH).
Примеры реакций взаимодействия щелочных металлов с водой:
- 2Na2O + H2O → 4NaOH
- K2O + H2O → 2KOH
Оксиды щелочных металлов также могут взаимодействовать с кислородом воздуха и образовывать соли щелочных металлов (например, угарный калий — K2CO3).
Некоторые оксиды не взаимодействуют с водой ни при каких условиях. Это оксиды более кислотных металлов (например, оксид алюминия — Al2O3). Они не реагируют с водой и не образуют гидроксиды.
Оксиды щелочных металлов и оксиды щелочноземельных металлов (например, оксид железа — Fe3O4) могут взаимодействовать с водой только после нагревания. При этом происходит их расщепление на соответствующий гидроксид и восстановление водорода.
Примеры реакций взаимодействия оксидов щелочноземельных металлов с водой:
- CaO + H2O → Ca(OH)2
- MgO + H2O → Mg(OH)2
В итоге, правило 12 заключается в следующем: оксиды щелочных металлов обычно взаимодействуют с водой, образуя гидроксиды или щелочи, а оксиды более кислотных металлов — нет. Оксиды щелочеземельных металлов могут взаимодействовать с водой только после нагревания.
Уроки по неорганической химии для подготовки к ЕГЭ
Одним из таких оксидов является CO2. Он не взаимодействует с водой и не образует кислотные или щелочные растворы. Также оксиды азота (NO и NO2) не реагируют с водой и остаются нерастворимыми.
Оксиды неметаллов, включая оксиды азота, являются типичными оксидами, которые не реагируют с водой. Однако они могут образовывать соединения с кислотами и основаниями. Например, оксид азота (NO2) реагирует с водой, образуя кислоту (HNO3) и оксид азота (NO).
Также с водой нереагируют оксиды некоторых активных металлов, таких как P2O5 и CuO. Они также могут реагировать с кислотами, образуя соответствующие соли, или с водородом, образуя соответствующие оксиды и воду.
Однако некоторые оксиды, например, P2O5, могут реагировать с водой в термическом режиме, образуя кислотные растворы. Также некоторые оксиды металлов, такие как Ca(OH)2 и Cu(OH)2, являются амфотерными и реагируют как с кислотными, так и с щелочными растворами.
При проведении уроков по неорганической химии для подготовки к ЕГЭ важно установить правило, что все оксиды, которые не реагируют с водой, не являются оксидами активных металлов. Вместе с тем, оксиды активных металлов являются одновременно и основными оксидами и окислителями. Например, оксид углерода (CO2) является типичным некислотным оксидом.
Химические свойства оксидов
Среди оксидов есть как кислотные, так и щелочные. Кислотные оксиды реагируют с водой, образуя кислоты, а щелочные оксиды реагируют с водой, образуя основания. Также есть оксиды, которые не реагируют с водой.
Правило, определяющее способность оксида реагировать с водой, называется правилом щелочности. По этому правилу, оксиды металлов в основном образуют щелочные растворы, а оксиды неметаллов в основном образуют кислотные растворы. Некоторые оксиды, такие как кислый оксид серы (SO2) или алюминия (Al2O3), могут реагировать как с кислотами, так и с щелочами.
Растворимость оксидов металлов и их реакциях с водой зависит от степени окисления металла. В общем случае, чем больше степень окисления металла, тем больше оксид щелочного металла растворяется в воде и тем быстрее протекает реакция образования щелочи. Например, оксид калия (K2O) образует сильную щелочь (KOH), а оксид натрия (Na2O) образует средней силы щелочь (NaOH). Однако оксиды металлов с низкой степенью окисления, такие как оксид железа (Fe2O3), могут взаимодействовать с водой, но не образуют щелочь.
Оксиды также могут растворяться в кислотах, образуя соль. В этом случае, оксиды металлов взаимодействуют с кислотами, образуя соль и воду. Например, оксид железа (Fe2O3) взаимодействует с соляной кислотой (HCl) и образует соль железа (III) хлорида (FeCl3) и воду.
Однако не все оксиды реагируют с водой или кислотами. Некоторые оксиды, такие как оксид азота (NO2) или оксид углерода (CO), не взаимодействуют с водой или кислотами, и их химические свойства могут быть использованы в качестве восстановителей или окислителей.
Важно отметить, что химические свойства оксидов могут быть различными в зависимости от соответствующей соли, образующейся при их реакции с водой или кислотой. Например, оксид кобальта (CoO) может реагировать с водой, образуя гидроксид кобальта (Co(OH)2), а оксид меди (CuO) может реагировать с кислотой, образуя соль меди (II) (CuCl2).
Таким образом, знание химических свойств оксидов позволяет определить их возможные реакции с водой и кислотами, а также использовать их в качестве химических средств в различных процессах подготовки неорганических соединений.
Видео:
12-3 Оксиды 0
12-3 Оксиды 0 by Natali Morozova 53 views 2 years ago 26 minutes