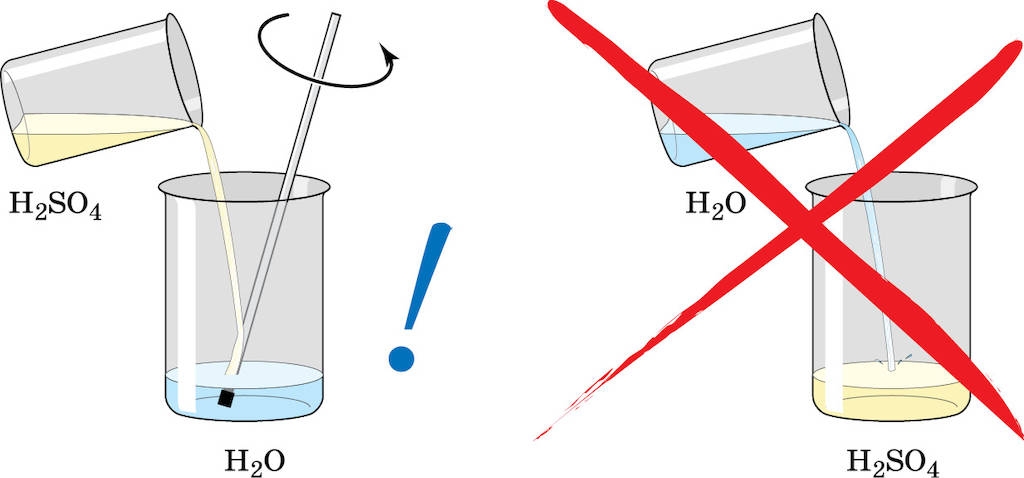
- Упрощение процесса разбавления соляной кислоты с использованием специального калькулятора водой
- Калькулятор разбавления соляной кислоты водой
- Требуемый раствор
- Исходный раствор
- Схема разведения раствора
- Соляная кислота
- Концентрация растворов. Способы выражения концентрации растворов
- Способы выражения концентрации растворов
- 1. Концентрация в моль/литр (М)
- 2. Концентрация в процентах (%)
- 3. Концентрация в моль-экв/литр (МЭ)
- 4. Концентрация pH
- 5. Концентрация в моль/кг
- Примеры постановки и расчета разбавления
- Калькулятор pH раствора
- pH раствора
- Сильная кислота Сильное основание
- Слабая кислота слабое основание
- Видео:
- Получение СОЛЯНОЙ кислоты
Упрощение процесса разбавления соляной кислоты с использованием специального калькулятора водой
Калькулятор разбавления сильной соляной кислоты водой является полезным инструментом, позволяющим определить требуемое количество воды для разбавления заданного количества сильной соляной кислоты до определенного pH значения раствора. Соляная кислота (HCl) — это одна из самых сильных кислот, широко используемая в различных областях химии и промышленности.
Сильная соляная кислота диссоциирует полностью в воде, образуя ион H+ и хлоридный ион Cl-. Ее активность и концентрация, выраженные в молярности, могут быть связаны в следующей формуле: активность HCl = молярность HCl × γHCl, где γHCl — коэффициент активности соляной кислоты. Для большинства случаев водных растворов HCl коэффициент активности примерно равен 1.
Растворение сильной соляной кислоты в воде может привести к образованию очень концентрированных растворов, которые могут быть опасными для безопасности. Разбавление кислоты водой позволяет получить более безопасный на использование и меньше травящий раствор.
Калькулятор разбавления соляной кислоты водой
Для выполнения расчета разбавления соляной кислоты необходимо знать молярную массу и требуемую концентрацию иононного раствора кислоты. Одним из способов рассчитать требуемое количество воды для разведения кислоты является использование массы или объема изначального раствора, а также желаемой концентрации разбавленного раствора.
Калькулятор разбавления соляной кислоты водой также может быть использован для определения объема гидроксида натрия (NaOH), который требуется для нейтрализации солей кислоты и получения разведенного раствора кислоты определенной концентрации. Диссоциация солей кислоты образует ионы гидроксида (OH-), которые могут нейтрализовать протоны (H+) кислоты и образовывать водные молекулы.
Для расчета разбавления соляной кислоты водой, можно использовать следующую схему:
- Определите исходную моляльность (концентрацию по массе в литре) соляной кислоты.
- Определите требуемую концентрацию (молярность) разбавленного раствора.
- Рассчитайте число молей соляной кислоты, необходимое для достижения требуемой концентрации.
- Рассчитайте массу соляной кислоты, которую необходимо разбавить водой для получения требуемого объема разведенного раствора.
- Рассчитайте объем воды, необходимый для разбавления соляной кислоты до требуемой концентрации.
Таким образом, калькулятор разбавления соляной кислоты водой позволяет рассчитать требуемое количество воды для разбавления соляной кислоты и получения растворов с заданной концентрацией.
Изменение концентрации кислот и оснований в растворе имеет важные практические применения, такие как регулирование pH и использование в процессах травления различных материалов.
Неверное разведение кислоты или основания может привести к нежелательным последствиям, поэтому рекомендуется использовать калькулятор разбавления соляной кислоты водой для правильного расчета объема и концентрации добавляемой воды.
Требуемый раствор
Для разбавления концентрированной соляной кислоты водой необходимо знать требуемую концентрацию раствора. Это можно рассчитать, используя калькулятор разбавления соляной кислоты.
Когда мы разбавляем соляную кислоту водой, получается раствор, содержащий воду и соляную кислоту в определенных пропорциях. Концентрация раствора обычно выражается в процентах или в молях.
В большинстве случаев, для разбавления концентрированной соляной кислоты используют воду в соотношении 1:1, то есть на каждый моль соляной кислоты приходится один моль воды.
Однако, в некоторых случаях требуется разбавить соляную кислоту до конкретной концентрации. Для этого нужно знать массу и титр концентрированной кислоты, а также объем и концентрацию требуемого раствора.
Способы разбавления соляной кислоты водой имеют некоторые отличия от способов разбавления оснований. Кислоты и основания диссоциируют по-разному в воде, поэтому нужно учитывать данный факт при разбавлении.
Основание обычно либо растворяется в воде, либо добавляется туда сначала. Поэтому, для разбавления раствора основания необходимо знать его массу и концентрацию, а также объем и концентрацию требуемого раствора.
В различных реакциях между кислотами и основаниями, отношение между числом молей кислоты и основания, а также число молей-эквивалентов кислоты и основания имеет большое значение.
Концентрация начального раствора определяется с помощью раствора кислоты или основания, которые диссоциируют в воде. Для этого используется показатель pH, который показывает степень кислотности или щелочности раствора.
В журнале можно найти схему разбавления соляной кислоты в воде и других материалов. Как правило, в начальном растворе есть концентрированная соляная кислота, которую нужно разбавить водой до требуемой концентрации.
При разбавлении соляной кислоты водой, следует учитывать состояние и концентрацию соляной кислоты в исходном растворе. Как правило, соляная кислота разбавляется до концентрации, меньшей чем 50%.
Чтобы рассчитать объем концентрированного раствора, необходимо знать его массу и концентрацию. Также можно рассчитать массу и концентрацию разбавленного раствора.
Итак, для того чтобы разбавить соляную кислоту водой до требуемой концентрации, необходимо знать массу и титр концентрированной соляной кислоты, а также объем и концентрацию требуемого раствора.
Калькулятор разбавления соляной кислоты водой поможет рассчитать все необходимые значения для разбавления и получения требуемого раствора.
Исходный раствор
Соляная кислота (HCl) — это химическое соединение, которое диссоциирует в воде и образует ионы водорода (H+) и ионы хлорида (Cl-). Она используется во многих областях науки и промышленности.
Исходный раствор соляной кислоты обычно продается в виде концентрированного раствора. Концентрация кислоты в исходном растворе может быть выражена в различных единицах, таких как моляльность, молярность или активность. Наиболее распространенной и простой в использовании является моляльность.
Моляльность (M) раствора определяется как количество молей растворенного вещества (в данном случае, HCl) на литр растворителя (в данном случае, воды). Например, исходный раствор соляной кислоты может иметь концентрацию 3 M, что означает, что на каждый литр воды приходится 3 моля HCl.
Теперь давайте рассмотрим способы расчета требуемого количества воды для разбавления исходного раствора.
Первый способ основан на разводе исходного раствора до определенной концентрации. Для этого необходимо знать молярность исходного раствора и требуемую концентрацию разведенного раствора. Этот способ основан на использовании формулы:
C1 × V1 = C2 × V2
где C1 — молярность исходного раствора, V1 — объем исходного раствора, C2 — требуемая концентрация разведенного раствора, V2 — объем растворителя (воды).
Второй способ основан на разводе исходного раствора до определенной активности. Активность — это понятие, которое связано с концентрацией ионообменной способности воды. Для этого способа требуется знать моляльность исходного раствора и требуемую активность разведенного раствора. Этот способ основан на использовании формулы:
a1 × γ1 = a2 × γ2
где a1 — моляльность исходного раствора, γ1 — активность исходного раствора, a2 — требуемая моляльность разведенного раствора, γ2 — требуемая активность разведенного раствора.
Оба способа позволяют определить, сколько воды необходимо добавить к концентрированному раствору соляной кислоты для получения требуемого разведенного раствора.
Зрения на выбор способа разбавления могут быть разные. В большинстве случаев концентрацией разводят на основании предполагаемого применения раствора.
Таким образом, исходный раствор соляной кислоты представляет собой сильную кислоту, которая диссоциирует в воде, образуя водные растворы с высокой концентрацией и активностью. Разбавление исходного раствора с помощью воды позволяет получить растворы с меньшей концентрацией и активностью, которые могут быть использованы в самых разных областях науки и промышленности.
Схема разведения раствора
Количество разбавляющей воды зависит от требуемого значения концентрации. Для расчета необходимо знать начальную концентрацию кислоты в молях/литре, а также требуемую концентрацию.
Формула для расчета количества воды для разведения кислоты:
- Рассчитайте массу раствора соляной кислоты, используя молярную массу HCl и единицы массы.
- Найдите количество вещества кислоты в моль-эквл.
- Рассчитайте требуемое количество воды при данной концентрации HCl и единицах объема.
Реакции между сильной кислотой и водой происходят с образованием гидроксид-ионов (OH-) и ионов водорода (H+). Сильное основание, например, гидроксид (NaOH), может быть либо использовано прямо для разбавления соляной кислоты, либо добавлено после разбавления. В обоих случаях образуется раствор, состоящий из соляной кислоты и гидроксида-ионов.
Интересные факты: сильная соляная кислота обычно имеет концентрацию около 37%, но она может быть разведена до более слабых концентраций в зависимости от требований приложения. Термин «соляной кислоты» относится к ее названию и химической формуле, причем молярный коэффициент равен 36.461 г/моль.
Соляная кислота
Расчет разбавления соляной кислоты с водой может быть полезным во многих случаях, например, при необходимости рассчитать количество кислоты, которое нужно добавить к определенной массе воды для получения раствора заданной концентрации. Для этого используется коэффициент разбавления, который определяется отношением объема концентрированного раствора к объему разбавляющего растворителя.
Например, для разбавления 1 моль соляной кислоты (HCl) в воде (H2O) мы можем использовать следующую схему:
- Рассчитываем массу концентрированного раствора, которую нужно добавить.
- Рассчитываем количество воды, которое следует использовать для разбавления.
- Расчитываем концентрацию полученного раствора.
Гидроксид водорода (H2O) является сильным основанием, поэтому при его реакции с соляной кислотой (HCl) образуются ионы H+ и Cl—. Сколько ионов будет растворено в водных растворах сильных кислот и оснований можно вычислить по формуле:
Активность воды = концентрация воды * 10-14
Значение концентрации воды (константа равновесия) равно 1 * 10-14 M2. Титр является числом разбавления и показывает, сколько раз раствор кислоты был разбавлен водой.
Титр HCl (кислота) = (концентрация ионов водорода в разбавленном растворе) / (концентрация ионов водорода в концентрированном растворе)
После дальнейшего расчета можно растворить заданное количество соляной кислоты в воде и получить требуемый раствор нужной концентрации.
Растворы соляной кислоты, в большинстве случаев, обладают высокой концентрацией и являются сильными коррозионными средствами. Поэтому необходимо быть осторожным при обращении с ними, соблюдать меры безопасности и использовать защитное снаряжение.
Использование калькулятора разбавления соляной кислоты с водой позволяет упростить процесс расчета и получить желаемый результат с минимальными усилиями.
Концентрация растворов. Способы выражения концентрации растворов
Один из способов выражения концентрации растворов — моляльность, которая определяется как количество молей растворенного вещества (в данном случае соляной кислоты) на единицу массы растворителя (воды). Моляльность обозначается как количество молей растворенного вещества (n) деленное на массу растворителя (m) в килограммах (Моль/кг). Для растворов соляной кислоты водой можно рассчитать моляльность следующим образом:
Моляльность = количество молей соляной кислоты / масса воды в кг.
Другой способ выражения концентрации растворов — процентное содержание, которое показывает долю растворенного вещества в 100 частях раствора. Процентное содержание может быть выражено в массах или объемах и обозначается как процент (в %). В случае с растворами соляной кислоты и воды можно рассчитать процентное содержание следующим образом:
Процентное содержание = (масса соляной кислоты / масса раствора) * 100%.
Также существуют другие способы выражения концентрации растворов, например, активность, pH и доля в водных растворах. Активность растворенного вещества показывает его реакционную способность в растворе. РН (показатель кислотности или щелочности) характеризует концентрацию ионов водорода в растворе. Доля в водных растворах выражает количество растворенного вещества в единице объема растворителя. Все эти способы имеют свои особенности и могут быть интересны при расчете и анализе растворов соляной кислоты водой.
Теперь, зная различные способы выражения концентрации растворов, можно рассчитать требуемый объем соляной кислоты или воды для получения определенной концентрации раствора.
Способы выражения концентрации растворов
Растворы могут выражаться в различных единицах, зависящих от способа измерения и характера раствора. Концентрация растворов может быть выражена через отношение количества растворенного вещества к объему растворителя или к массе раствора.
1. Концентрация в моль/литр (М)
Один из самых распространенных способов выражения концентрации раствора — концентрация в моль/литр (М). Концентрация раствора в моль/литр (М) определяется как количество вещества (в молях), растворенного в 1 литре растворителя.
2. Концентрация в процентах (%)
Концентрация раствора может быть выражена в процентах (%), что показывает какую долю занимает растворенное вещество в растворе. Обычно используется массовый (весовой) процент, который определяется как масса растворенного вещества, деленная на массу раствора и умноженная на 100%.
3. Концентрация в моль-экв/литр (МЭ)
Концентрация раствора может быть выражена в моль-экв/литр (МЭ), где моль-эквивалент (моль-экв) определяется как количество вещества, эквивалентного концентрации ионообразующегося вещества. Для расчета концентрации в моль-экв/литр (МЭ) необходимо учитывать диссоциацию растворенного вещества в растворе.
4. Концентрация pH
В некоторых случаях концентрация раствора может быть выражена через концентрацию ионов водорода (H+) в растворе, измеренную в единицах pH. pH определяет активность ионов водорода и показывает, является ли раствор кислым (pH<7), нейтральным (pH=7) или щелочным (pH>7).
5. Концентрация в моль/кг
Еще один способ выражения концентрации раствора — концентрация в моль/кг (моль/килограмм). Данный способ используется для выражения концентрации раствора в моль на каждый килограмм растворителя или раствора.
Все эти способы выражения концентрации растворов связаны с определением количественного соотношения вещества к растворителю или раствору, и отражают активность вещества в состоянии растворения.
Примеры постановки и расчета разбавления
Допустим, у нас есть 0.5 литра 1 М раствора соляной кислоты (HCl). Нам нужно разбавить его до концентрации 0.1 М HCl. Для этого растворим 0.1 моль HCl в воде до 0.5 литра. Таким образом, концентрация HCl в полученном растворе будет составлять 0.1 М.
Использование калькулятора разбавления соляной кислоты водой позволяет точно определить, сколько литров воды нужно добавить к заданному объему соляной кислоты для достижения требуемой концентрации.
| Объем данной соляной кислоты (HCl) в литрах | Объем воды, которая должна быть добавлена (в литрах) |
|---|---|
| 0.5 | 4.5 |
| 0.75 | 3.25 |
| 1 | 3 |
| 1.25 | 2.75 |
| 1.5 | 2.5 |
Калькулятор pH раствора
Вода является слабо диссоциированным растворителем, что означает, что только небольшая доля воды распадается на ионы водорода (H+) и гидроксидные ионы (OH-). Сильные кислоты и основания полностью диссоциируют в воде, образуя ионы H+ и OH-, соответственно, в то время как слабые кислоты и основания диссоциируются менее полностью.
Титр – это значение концентрации, выраженное в единицах молярности кислоты или основания, которая растворена в воде. Расчет pH раствора может быть выполнен различными способами, однако наиболее распространенным является использование формулы pH = -log[H+].
Калькулятор pH раствора позволяет определить pH раствора соляной кислоты в воде. Для этого необходимо ввести массу соляной кислоты и объем воды, в которой она будет разбавлена. Коэффициент травления соляной кислоты равен двум, что означает, что две молекулы воды требуются для полного растворения одной молекулы соляной кислоты.
Расчет pH раствора соляной кислоты можно выполнить с использованием формулы pH = -log[H+], где [H+] – концентрация водородных ионов в растворе. Поскольку соляная кислота является сильной кислотой, она полностью диссоциирует в воде, что означает, что каждая молекула соляной кислоты диссоциирует в один H+ и один Cl- ион.
Зная массу соляной кислоты и объем воды, можно вычислить моляльность соляной кислоты в растворе. Дальше, используя коэффициент травления, можно вычислить количество молекул соляной кислоты и воды, участвующих в реакции разбавления. Затем, рассчитывается концентрация водородных ионов в растворе с помощью выражения [H+] = (концентрация HCl * коэффициент травления) / объем раствора.
Интересные факты о pH: pH 7 соответствует нейтральной среде, значения pH менее 7 соответствуют кислотной среде, а значения pH более 7 – щелочной среде. Для каждое изменение значение pH на единицу означает 10-кратное изменение концентрации водородных ионов. Таким образом, раствор с pH 1 содержит 10 раз больше водородных ионов, чем раствор с pH 2.
Калькулятор pH раствора – это полезный инструмент при работе с различными растворами кислот и оснований. Он позволяет определить кислотность или щелочность раствора, принять соответствующие меры для регулирования pH и использовать нужные материалы и способы для разбавления растворов сильной или слабой кислоты или основания.
pH раствора
Расчет pH раствора зависит от концентрации ионов водорода в нем. Например, в калькуляторе разбавления соляной кислоты водой можно рассчитать pH раствора, зная количество кислоты и воды в литрах.
Для рассчета pH раствора с использованием формулы, необходимо знать молярную массу кислоты, концентрацию кислоты в растворе (в процентах или молях), а также моляльность раствора.
Существуют различные способы измерения pH растворов. Один из них — использование pH-метра, который позволяет определить точную концентрацию ионов водорода в растворе. Другой способ — использование индикаторов, которые меняют свой цвет в зависимости от pH раствора.
Также следует учитывать активность ионов водорода в растворе, которая может отличаться от их концентрации.
В водных растворах сильных кислот, например, соляной кислоты, ионы кислоты полностью диссоциируют и являются активными. В растворах слабых кислот и оснований активность может быть меньше концентрации.
Важно понимать, что pH раствора может быть отношением концентрации ионов водорода к количеству растворителя (воды). Также pH раствора может быть выражен в логарифмической формуле.
В журнале интересные статьи о pH растворов, где они рассчитываются и указывается их значение для разных реакций и растворов. Также в журнале можно прочитать о способах рассчитать pH растворов, включая использование титра, массы и др.
Сильная кислота Сильное основание
Для определения концентрации сильной кислоты в растворе используется понятие молярности. Молярность гидроксида натрия, сильного основания, и моляльность сильной кислоты связаны с показателем рН. Поэтому, при разбавлении концентрированного раствора сильной кислоты в воде, можно измерять показатель рН и определять концентрацию растворенной кислоты.
Существует несколько способов разбавления сильной кислоты водой. Калькулятор разбавления соляной кислоты водой позволяет определить, сколько воды нужно добавить к определенному объему сильной кислоты для получения раствора с желаемой концентрацией. Такой калькулятор может быть полезен в лаборатории или в образовательных целях для определения объема воды, который необходим для разбавления сильной кислоты до определенной концентрации.
Сильная кислота и сильное основание являются взаимно нейтральной парой в химическом тракте. Когда они взаимодействуют в определенных количествах, они полностью реагируют друг с другом и образуют нейтральное соединение. Поэтому, после того, как сильная кислота разведена водой до требуемой концентрации, она может быть использована для различных химических процессов, таких как травление металлов или использование в коллегии.
Теперь вы знаете, что сильная кислота и сильное основание играют важную роль в растворении и разбавлении кислоты. Концентрация и разбавление сильной кислоты в зависимости от количества воды могут быть определены с использованием калькулятора разбавления кислоты водой.
Слабая кислота слабое основание
Соляная кислота (HCl) и вода (H2O) оба диссоциируют в своих молекулярных формах. В случае соляной кислоты диссоциация выглядит следующим образом: HCl = H+ + Cl-. В случае воды: H2O = H+ + OH-. Кислота отдает протон (H+) воде, образующей Гидроксид ион (OH-), что приводит к образованию сильного основания и нейтрализации кислоты.
Если рассматривать концентрацию H+ и OH- ионов, то можно использовать калькулятор концентрации соляной кислоты, чтобы рассчитать требуемое количество воды для разведения. К сожалению, сильное основание (OH-) может быть получено только путем добавления кислоты в воду. Поэтому другой способ — добавление кислоты в воду.
При добавлении соляной кислоты в воду возможно два случая. В одном из них гидроксид разбавляется в воде, а в другом — кислота. Когда гидроксид растворяется в воде, у нас есть кислота, имеющая меньшую концентрацию, чем сначала. Однако, когда мы льём воду в уже разведённый гидроксид, концентрация гидроксида будет меньше, чем в случае с кислотой.
Слабое основание может быть представлено гидроксидом или ионом, который распадается на гидроксид и катион. Например, NaOH = Na+ + OH-. Раствор, содержащий нейтральную кислоту и слабое основание, может быть тутже использован в разведении HCl.
Теперь, рассмотрим способ расчета разведения соляной кислоты с помощью воды. Вода добавляется в соль HCl очень медленно, литр за литром. Это приводит к постепенному снижению концентрации H+. Молекулярная масса соли и объем добавляемой воды определяют массу и концентрацию раствора в каждое новое внесение. Затем вычисляется отношение конечной и начальной концентраций, определяющее мольные эквиваленты гидроксида или кислоты в растворе.
В расчете разложения HCl в воде может использоваться и другой метод. Концентрация H+ и OH- может быть рассчитана путем измерения концентрации раствора после добавления воды. Такой метод требует использования специализированного оборудования и материалов. Дальше полученные значения концентраций используются для расчета объема воды, необходимого для разведения некоторого количества раствора соляной кислоты. Всего два способа, непосредственное добавление воды и растворение гидроксида HCl, могут использоваться в этом случае.
Видео:
Получение СОЛЯНОЙ кислоты
Получение СОЛЯНОЙ кислоты de Verrum 26 098 vues il y a 2 ans 10 minutes et 54 secondes