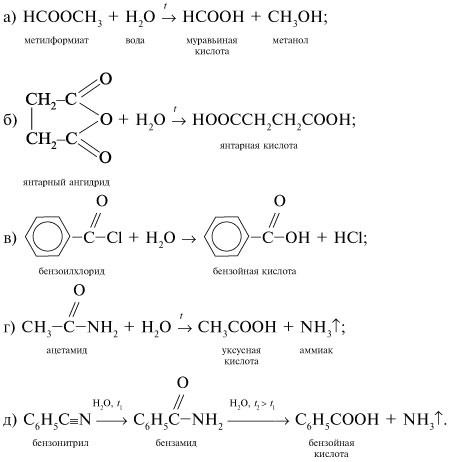
- Процесс гидролиза метилацетата с использованием воды
- Сложные эфиры: способы получения и свойства
- 1. Восстановление солей карбоксильных кислот
- 2. Этилацетат гидролиз в щелочной среде
- 3. Переэтерификация с галогеналканами
- Классификация сложных эфиров
- 1. Эфиры карбоновых кислот
- 2. Эфиры карбоксильных кислот и глицерина
- 3. Эфиры с галогеналканами
- По числу карбоксильных групп
- Номенклатура сложных эфиров
- Химические свойства сложных эфиров
- Общая классификация сложных эфиров:
- Свойства эфиров:
- 2 Переэтерификация
- 3 Способы получения и свойства переэтерификации
- 3Восстановление сложных эфиров
- Описание восстановления сложных эфиров
- Классификация сложных эфиров
- Способы восстановления сложных эфиров
- Видео:
- Разложение воды недетским напряжением. Механизм диссоциации. H2-13
Процесс гидролиза метилацетата с использованием воды
Метилацетат (CH3COOCH3) — один из самых химически стабильных сложных эфиров. Этот синтетический органический соединитель элемента органической химии относится к классу эфиров карбоновых кислот, получение которых является результатом реакции эфтерификации.
Метилацетат относится к группе сложных эфиров. У него есть несколько свойств, которые делают его таким особенным. Во-первых, метилацетат обладает сложной номенклатурой, что делает его классификацию нетривиальной. Во-вторых, его свойства и реакция на гидролиз сильно отличаются от простой ацетата этила (СН3СООС2Н5) и других эфиров. Также следует отметить, что метилацетат может образовываться как результат переэтерификации карбоксильных групп и сложных эфиров с участием гидролизе.
Гидролиз метилацетата с водой приводит к образованию уксусной кислоты (СН3СООН) и метилового спирта (CH3ОН). Такая реакция является обратимой и происходит в щелочной среде. Получение метилацетата может осуществляться различными способами, включая этерификацию глицерина, переэфирификацию сложных эфиров и другие методы.
Сложные эфиры: способы получения и свойства
1. Восстановление солей карбоксильных кислот
Один из способов получения сложных эфиров основывается на восстановлении солей карбоксильных кислот. Для этого используется метилформиат или глицерин — это химические соединения, которые содержат группы гидроксила и группы карбоновой кислоты. Результатом реакции будет получение эфиров группы acetyl.
2. Этилацетат гидролиз в щелочной среде
Для получения сложных эфиров можно использовать гидролиз этилацетата в щелочной среде, например, с натрием. В результате гидролиза происходит замещение группы гидроксила (-OH) на группу карбоновой кислоты (-COOH).
3. Переэтерификация с галогеналканами
Еще один способ получения сложных эфиров — это переэтерификация с галогеналканами. При этом происходит замена группы гидроксила на группу карбоновой кислоты в присутствии галогеналкана.
Сложные эфиры обладают рядом свойств, которые определяются особенностями структуры и групп, присутствующих в их молекуле. Общая классификация эфиров основывается на числе групп гидроксила и карбоновой кислоты, присутствующих в молекуле.
Химические реакции сложных эфиров включают переэтерификацию, гидролиз, спиртами, восстановление солей карбоксильных кислот и другие. Свойства сложных эфиров определяют их физические и химические характеристики, а также их взаимодействие с другими веществами.
Классификация сложных эфиров
1. Эфиры карбоновых кислот
К данной группе относятся сложные эфиры, образованные из карбоновых кислот. Например, уксусная кислота может образовать этиловый эфир — этилацетат. Для получения эфиров данной группы часто используется переэтерификация, то есть реакция кислотной группы с алкоголем или солью щелочного металла.
2. Эфиры карбоксильных кислот и глицерина
Эфиры данной группы образуются из карбоксильных кислот и глицерина. Например, метилформиат получается путём обратной реакции между формиатом натрия и метанолом. Номенклатура таких сложных эфиров основана на названиях исходных кислот и глицерина, с указанием соответствующих групп и элемента группы.
3. Эфиры с галогеналканами
Этот тип сложных эфиров получается путём замещения водорода в алкановой цепи галогеном. Например, метилацетат — это эфир, в котором ацетатная группа связана с группой метилефира. Получение эфиров данной группы осуществляется путём реакции этерификации между соответствующей кислотой и галогеналканом.
Сложные эфиры обладают рядом химических свойств, таких как восстановление кислотной группы до карбоксильной или группы глицерина до соответствующего спирта. Также они могут образовывать соли с щелочными металлами. Эфиры часто используются в различных химических реакциях и промышленности благодаря своей устойчивости и хорошей растворимости в органических растворителях.
По числу карбоксильных групп
Сложные эфиры, получаемые в результате переэтерификации сложных солей, номенклатурно называются по числу карбоксильных (функциональных) групп в их молекулах. Например, для получения метилацетата из метилформиата и уксусной кислоты применяют следующую реакцию:
CH3COONa + CH3OH ⇌ CH3COOCH3 + NaOH
Гидролиз этого эфира в щелочной среде приводит к получению уксусной кислоты и метанола:
CH3COOCH3 + NaOH → CH3COONa + CH3OH
Эфир может быть получен также путем этерификации уксусной кислоты метанолом:
CH3COOH + CH3OH ⇌ CH3COOCH3 + H2O
Сложные эфиры могут содержать в своей молекуле две или более карбоксильные группы. В этом случае они называются дикислотными или поликислотными эфирами. Способы получения дикислотных эфиров аналогичны получению монокарбоксильных эфиров. Например, получение этилацетата:
CH3COOH + C2H5OH ⇌ CH3COOC2H5 + H2O
Особенности свойств сложных эфиров определяются наличием нескольких функциональных групп. Например, сложные эфиры могут образовывать сложные соли с элементами щелочных и щелочноземельных металлов. Также они могут подвергаться восстановлению в присутствии гидридов элементов группы 3. В результате гидролиза сложных эфиров обычно получают соответствующие кислоты и спирты.
Классификация эфиров по числу карбоксильных групп включает в себя моноэфиры, диэфиры, триэфиры и так далее. Кроме того, эфиры подразделяются на насыщенные и несвободные по карбоновым атомам. Также эфиры могут быть классифицированы в соответствии с их кислотно-основными свойствами.
Номенклатура сложных эфиров
Одним из примеров сложных эфиров являются глицериновые эфиры. Они получаются из глицерина и карбоновых кислот. Эти эфиры могут быть получены с помощью переэфтерификации кислоты с глицерином и обратной реакции — гидролиза эфира с образованием кислоты.
Другим примером является метилацетат — сложный эфир, образованный из метилового спирта и уксусной кислоты. Этот эфир может быть получен путем метода этерификации, где метиловый спирт и уксусная кислота реагируют в присутствии сильной кислоты в среде реакции. Метилацетат также может быть подвергнут гидролизу с образованием метилформиата и элементарной кислоты.
Помимо этого, существует классификация сложных эфиров в зависимости от групп, которые они содержат, их свойств и способов получения. Эфиры могут образовывать соли с щелочными и кислотными группами, а также реагировать с галогеналканами.
В результате гидролиза сложных эфиров с водой образуются карбоксильные кислоты и соответствующие соли с натрием или другими металлами.
Химические свойства сложных эфиров
Сложные эфиры могут быть получены различными способами. Например, они образуются при взаимодействии карбоновых кислот и спиртов с образованием соответствующих эфиров. Также сложные эфиры могут получаться путем переэтерификации, когда происходит замена одного остатка R-OH на другой.
Для получения сложных эфиров можно использовать различные кислоты, например, нафталинсульфонаевую кислоту или гидросульфат натрия. Кроме того, сложные эфиры можно получить путем реакции эфира с гидролизом карбоновых кислот или галогеналканами.
Сложные эфиры подразделяются на несколько классов в зависимости от химических свойств. Например, в класс эфиров входят этилацетат, метилацетат и метилформиат. Они обладают различными химическими свойствами и могут использоваться в разных областях.
Общая классификация сложных эфиров:
1. Сложные эфиры кислоты азотной: глицерилацетат, глицерилнитрит, этиленгликольдицетат и др.
2. Сложные эфиры кислоты галогенной: этилацетат, метилацетат, метилбромацетат и др.
3. Сложные эфиры кислоты серной: этидицилсульфат, этилацетатсульфат, метилацетатсульфат и др.
Сложные эфиры обладают свойствами, которые могут быть использованы в различных областях. Например, они являются хорошими растворителями для органических веществ и могут использоваться в процессе экстракции. Кроме того, они обладают низкой температурой кипения, что делает их удобными для использования в парфюмерии и косметике.
Свойства эфиров:
1. Чувствительность к гидролизу: эфиры подвержены гидролизу при действии воды и щелочей, при этом происходит разрушение связи между кислородом и атомом углерода.
2. Восстановление: эфиры могут быть восстановлены до соответствующего спирта или алкана путем химических реакций.
3. Номенклатура: для названия эфиров используется систематическая номенклатура, которая включает указание остатка углеводорода в качестве приставки R- и названия кислоты.
Таким образом, сложные эфиры обладают разнообразными химическими свойствами и находят применение в различных отраслях науки и промышленности.
2 Переэтерификация
Описание процесса:
- Переэтерификация основана на замене одной карбоновой группы в сложном эфире на другую.
- В ходе реакции, карбоновая группа R-OH эфира заменяется на карбоновую группу С-О-R’
- При этом образуются сложные эфиры с новыми карбоновыми группами и высвобождается соответствующий спирт.
Классификация переэтерификации:
Переэтерификация может проводиться с использованием сложных эфиров различного типа. Наиболее распространенными веществами для проведения этой реакции являются уксусная кислота и ее сложные эфиры.
3 Способы получения и свойства переэтерификации
Получение:
Переэтерификация может быть получена путем взаимодействия сложных эфиров с алкилгалогенами. Химические свойства сложных эфиров позволяют проводить эту реакцию с высокой степенью эффективности.
- Способ №1: Общая переэтерификация
- Способ №2: Переэтерификация с галогеналканами
Общая переэтерификация представляет собой обмен карбоновых групп между сложными эфирами и спиртами в присутствии щелочей или солей натрия.
Переэтерификация с галогеналканами основана на реакции сложного эфира с галогенсодержащим соединением, в результате которой происходит замена одной карбоновой группы на карбоновую группу галогеналкана.
Результат и свойства:
В результате переэтерификации образуются новые сложные эфиры с измененными карбоновыми группами. Эти эфиры могут иметь разнообразные химические свойства, в зависимости от состава и структуры исходных соединений.
Переэтерификация является важной химической реакцией, которая позволяет получать разнообразные сложные эфиры с новыми химическими свойствами.
3Восстановление сложных эфиров
Свойства сложных эфиров отличаются от свойств простых эфиров, так как в сложных эфирах карбоновой кислоты присутствует карбоновый атом с группой acetyl ( CH3COO ). При гидролизе сложных эфиров в щелочной среде, метилацетат может образовать соли карбоновых кислот. Так, при гидролизе метилацетата с натрием получается натриевая соль уксусной кислоты: CH3COOCH3 + NaOH → CH3COONa + CH3OH
Сложные эфиры также могут подвергаться реакции переэтерификации с галогеналканами. Результатом такой реакции является получение сложного эфира и соли карбоновых кислот: CH3COOCH3 + RX → CH3COOR + RX (где R — алкильная группа)
Описание восстановления сложных эфиров
Восстановление сложных эфиров может осуществляться с помощью спиртов. При этом карбоновая группа acetyl превращается в одну или несколько гидроксильных групп. Например, при реакции восстановления метилацетата с метанолом образуется метилформиат: CH3COOCH3 + CH3OH → HCOOCH3 + CH3OH
Классификация сложных эфиров
Сложные эфиры можно классифицировать по наличию групп acetyl в молекуле. Например, этилацетат (CH3COOC2H5) относится к сложным эфирам, так как в его молекуле присутствует группа acetyl.
Свойства сложных эфиров подчиняются общим закономерностям химического состава и структуры. Например, они обладают химическими свойствами карбоксильных кислот и спиртов.
Получение сложных эфиров включает в себя процесс переэтерификации. Это реакция карбоновых кислот или их солей с спиртами с образованием сложных эфиров и воды. Например, при получении сложного эфира метилацетата с метанолом, реакционная смесь содержит метилформиат: CH3COOH + CH3OH → CH3COOCH3 + H2O
Сложные эфиры также могут образовываться при взаимодействии глицерина с кислотами, например, при получении сложного эфира глицерилдиуксусной кислоты.
Способы восстановления сложных эфиров
- Гидролиз сложных эфиров при присутствии воды и действии соляных кислот или баз:
- Сложный эфир + вода → карбоновая кислота + спирт
- Выделение карбоновой кислоты восстановительным окислением сложных эфиров с помощью химических реагентов:
- Сложный эфир + химический реагент → карбоновая кислота
Таким образом, восстановление сложных эфиров позволяет получить карбоновые кислоты и спирты, а также использовать их в различных химических реакциях.
Видео:
Разложение воды недетским напряжением. Механизм диссоциации. H2-13
Разложение воды недетским напряжением. Механизм диссоциации. H2-13 by SeAlDo #Эксперименты 13,371 views 2 months ago 10 minutes, 15 seconds