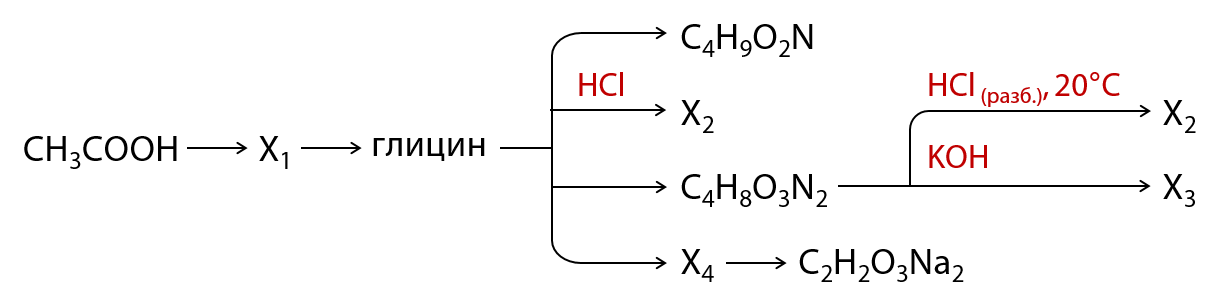
Реакция глорирования пропена с хлорной водой.
Пропен (C3H6) – это непредельный углеводород из класса алкенов, состоящий из трех углеродных атомов и шести атомов водорода. Он обладает двойной связью между углеродными атомами, что позволяет ему участвовать во многих химических реакциях.
Одной из важных реакций пропена является его хлорирование при присоединении хлорной воды (реакция гидрогалогенирования). В данной реакции пропен присоединяет молекулу хлороводорода (HCl), и в результате образуется гидрохлорид пропилена (C3H7Cl).
Помимо гидрогалогенирования, пропен может претерпевать и другие реакции. Например, при окислении пропена кислородом происходит образование кетона — пропанона (CH3COCH3). Это реакция, при которой два атома кислорода присоединяются к молекуле пропена.
Еще одной важной химической реакцией, в которую вступает пропен, является горение. При нагревании пропена с перманганатом (KMnO4) происходит каталитическое окисление пропена, в результате чего образуется карбоновая кислота.
Таким образом, пропен обладает высокой химической активностью и может претерпевать различные реакции, в результате которых образуются различные продукты.
Химические свойства алкенов
Алкены обладают разнообразными химическими свойствами. Они могут участвовать в различных реакциях:
- Горение: алкены сгорают в присутствии кислорода с выделением большого количества тепла.
- Гидрирование: в результате реакции с водородом, двойная связь алкена превращается в одинарную.
- Окисление: алкены могут окисляться различными окислителями, например, перманганатом калия. При этом происходит разрыв двойной связи и образуется вещество с насыщенным углеродным скелетом.
- Галогенирование: при взаимодействии алкенов с хлором, бромом или йодом происходит замещение водородных атомов двойной связи атомами галогенов.
- Гидроалогенирование: при этой реакции к алкену присоединяется галогеноводородная кислота (например, HCl). В результате происходит разрыв двойной связи и образуется хлорированное или бромированное соединение.
- Замещение: атомы водорода в алкене могут быть замещены другими атомами или группами атомов.
Некоторые реакции алкенов могут протекать под воздействием света (фотохимическое воздействие) или каталитических систем.
Химические свойства алкенов определяются наличием двойной связи и электрофильной природой этой связи. Также алкены могут реагировать с кислородом воздуха при жестком нагревании или взаимодействии с катализаторами.
Химические свойства алкенов
Алкены образуются при изомеризации алканов, хлорировании алканов при присутствии каталитических или электрофильных катализаторов, при разрыве атомных связей в молекуле воды. Атомы кислорода и воды преимущественно вступают в присоединение к алкенам.
При хлорировании алкенов образуется хлорированный кетон с изомеризацией и замещением боковой связи. При гидрогалогенировании алкены вступают в присоединение к молекуле галогена с образованием новой связи между атомами галогена и углерода.
Взаимодействие алкенов с кислородом приводит к окислению поэтому алкены образуются в присутствии окислителя, такого как перманганат калия или хлорная вода. Атомы кислорода присоединяются к атомам углерода с разрывом двойной связи и образованием новой σ-связи. Вода может присоединяться к алкенам при нагревании в присутствии кислорода и каталитического вещества, например, жесткого перманганата калия.
Химические свойства алкенов также проявляются при свету и взаимодействии с кислыми гидроокисями. При световом воздействии алкены подвергаются изомеризации, а также происходит замещение в боковой связи при взаимодействии с кислотами или основаниями.
1 Реакции присоединения
Присоединение хлорной воды к пропену происходит путем гидрогалогенирования, то есть присоединения галогена (в данном случае хлора) к двойной связи атому углерода алкена. В ходе реакции образуется хлорированное соединение, которое может далее претерпевать различные химические превращения.
Механизм реакции присоединения пропена к хлору состоит из двух этапов. На первом этапе происходит электрофильное взаимодействие молекулы хлора с двойной связью пропена, в результате чего образуется электрофильный интермедиат. На втором этапе происходит замещение хлора атомом водорода из молекулы хлорной воды, образуя хлорированное соединение и воду.
Помимо галогенирования, пропен может вступать в реакции присоединения с другими химическими соединениями. Например, при взаимодействии с кислородом в присутствии катализатора происходит окисление пропена, образуя кетон. Также возможны реакции присоединения пропена с кислотами, гидроокисление и гидрирование.
Одной из интересных реакций присоединения является присоединение перманганата к пропену. В результате этой реакции происходит разрыв двойной связи и образуется кислород. В ходе реакции может образовываться множество различных продуктов.
Реакции присоединения пропена к хлорной воде могут происходить как при комнатной температуре, так и при нагревании или воздействии света. В зависимости от условий, могут образовываться различные продукты реакции.
| Реакция | Уравнение | Описание |
|---|---|---|
| Гидрогалогенирование | CH2=CH2 + HCl → CH3CH2Cl | Присоединение молекулы HCl к двойной связи атома углерода пропена |
| Окисление | CH2=CH2 + O2 → CH3C(=O)CH3 | Присоединение молекулы кислорода к двойной связи атома углерода пропена с образованием кетона |
| Гидрирование | CH2=CH2 + H2 → CH3CH3 | Присоединение молекулы водорода к двойной связи атома углерода пропена с образованием обычного углеводорода |
11 Гидрирование
В гидрировании непредельных углеводородов, таких как алкены, происходит присоединение водорода к двум атомам углерода, что приводит к образованию непредельных углеводородов, в которых число связей между атомами углерода увеличивается на 2. Например, гидрирование пропилена (C3H6) приводит к образованию пропана (C3H8).
Гидрирование является обратной реакцией к дегидрированию и может происходить при наличии катализатора, например, палладия или никеля. Гидрирование является важным процессом в производстве топлива и химических веществ.
В процессе гидрогалогенирования алкенов, водород присоединяется вместо галогена. Гидрогалогенирование может происходить с образованием более одного продукта, например, при гидрогалогенировании 2-хлорпропена (C3H5Cl) образуется пропан (C3H8) и хлорид водорода (HCl).
Гидратация — это реакция присоединения воды к веществу. Например, гидратацией этилена (C2H4) образуется этиленгликоль (C2H6O2).
Гидрирование является важным процессом в химии и используется во многих промышленных процессах, таких как производство пластика и нефтепереработка.
12 Галогенирование алкенов
В процессе галогенирования алкенов могут происходить различные реакции. Например, при хлорировании пропилена (C3H6) образуется хлорпропан (C3H6Cl). В реакции один атом водорода в молекуле пропилена замещается атомом хлора. При этом π-связь алкена превращается в σ-связь соединения с Хлором.
Галогенирование алкенов происходит при участии катализаторов или при воздействии света. Например, при добавлении хлорной воды к пропену в присутствии перманганата калия происходит добавление галогена (хлора) к π-связи. При этом π-связь алкена окисляется, образуя гидроксильные группы.
Галогенирование алкенов может привести к образованию n-предельных соединений. Например, при хлорировании пропена (C3H6) образуются хлорпрэн и хлорпропан. При этом один из углеродных атомов алкена остается непокрытым галогенами, что вызывает возможность образования измененной цепи из n-предельных углеродных атомов.
Галогенирование алкенов также может происходить без катализаторов, например, озонированием. Озонирование алкенов — это реакция сгорания алкенов в присутствии кислорода. При этом происходит окисление π-связи алкена до образования двойной связи кетона или альдегида.
Свойства галогенированных алкенов зависят от числа и положения галогенных атомов в молекуле. Галогенированные алкены обладают мягким окислению, поэтому могут быть использованы в реакциях окисления и кетонов.
Галогенирование алкенов может также приводить к образованию полимеров. Например, при хлорировании этилена (C2H4) образуется полихлорэтилен. Полимеризация происходит при соединении молекул этилена в длинные цепочки через π-связь.
13 Гидрогалогенирование алкенов
В процессе гидрогалогенирования протекает реакция присоединения, а хлорная или бромная вода действуют как гидрогенации и гидрирования.
Гидрогалогенирование алкенов происходит при нагревании или освещении в присутствии каталитических веществ, таких как жесткий каталитический калий (21) или перманганат калия (23).
В результате гидрогалогенирования образуются галогиды алканов. При этом молекулы галогена присоединяются к алкенам, разрывая двойную связь и образуя новые связи с атомами углерода.
Гидрогалогенирование обычно протекает по правилу Марковникова, согласно которому один из атомов галогена присоединяется к углероду, который содержит наибольшее число водородных атомов.
Гидрогалогенирование часто применяется для получения галогированных углеводородов, которые находят широкое применение во многих областях промышленности.
Гидрогалогенирование алкенов — это один из методов преобразования двойной связи алкена в одинарную связь. В результате этой реакции образуются галогиды алканов, которые могут быть использованы как промежуточные продукты в получении других веществ.
14 Гидратация
| Вещество | Уравнение реакции | Свойства гидратов |
|---|---|---|
| Пропилен | C3H6 + H2O → CH3CH2OH | Гидратация пропилена протекает каталитически, под воздействием света или при нагревании. Гидраты пропилена используются в качестве растворителей и в производстве различных органических соединений. |
| Этилен | C2H4 + H2O → CH2CH2OH | Гидратация этилена происходит каталитически при наличии кислорода или ионов металлов. Гидраты этилена используются в производстве полимеров, в том числе и полиэтилена. |
Помимо гидратации, алкены также могут подвергаться другим реакциям, таким как гидрогалогенирование, окисление и полимеризация. В реакции гидрогалогенирования вместо воды к двойной связи алкенов присоединяется галоген (например, хлор). При окислении алкенов под воздействием кислорода или других окислителей происходит разрыв двойной связи и образуется кетон. Полимеризация алкенов приводит к образованию полимерных цепей из молекул алкенов.
15 Полимеризация
Пропен — алкен с молекульной формулой C3H6. При подвергании пропена воздействию хлорной воды происходит гидрогалогенирование, то есть присоединение атомов водорода и хлора к двойной связи. Уравнение реакции пропена с хлорной водой будет выглядеть следующим образом:
CH3CH=CH2 + HCl + H2O → CH3CHClCH3
При гидрогалогенировании алкенов обычно используются катализаторы, например, ртути или платины. Катализаторы активируют молекулы хлорной воды, ускоряя процесс присоединения атомов водорода и хлора к молекуле пропена.
Также у пропена есть свойство окисляться при нагревании или под действием света. В результате этого окисления образуются алканы или цепи непредельных кислот. Например, при окислении пропена образуется пропионовая кислота:
CH3CH=CH2 + O2 → CH3CH2COOH
Молекула пропена также может претерпевать изомеризацию, то есть изменять свою структуру, при этом сохраняя общую формулу и количество атомов. Например, изомеризацией пропена может образоваться изо-пропен:
CH3CH=CH2 ⇌ CH2=C(CH3)2
Пропен также может претерпевать реакцию хлорирования, при которой на молекуле пропена образуются соединения с хлором. Пропен хлорируется в соответствии с правилом Марковникова, поэтому при хлорировании образуются разные изомеры хлорпропана в зависимости от условий реакции.
Таким образом, пропен проявляет свою химическую активность в различных реакциях, связанных с присоединением или окислением атомов и группа к молекуле.
| Реакция | Уравнение |
|---|---|
| Гидрогалогенирование | CH3CH=CH2 + HCl + H2O → CH3CHClCH3 |
| Окисление | CH3CH=CH2 + O2 → CH3CH2COOH |
| Изомеризация | CH3CH=CH2 ⇌ CH2=C(CH3)2 |
| Хлорирование | CH3CH=CH2 + Cl2 → CH3CHClCH2Cl |
Видео:
Химия. 8 класс. Реакции металлов с водой /16.10.2020/
Химия. 8 класс. Реакции металлов с водой /16.10.2020/ by EL ARNA 2,356 views 3 years ago 12 minutes, 57 seconds