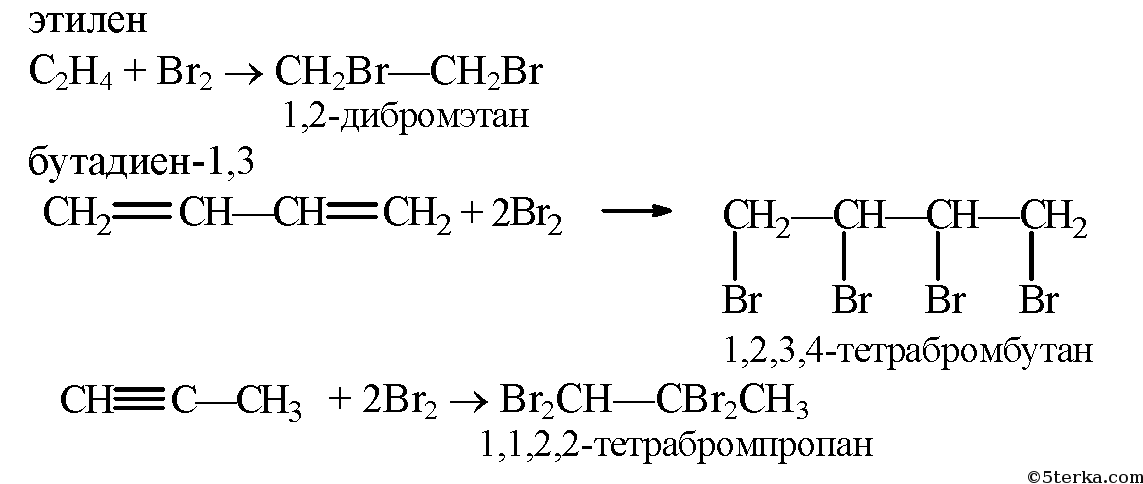
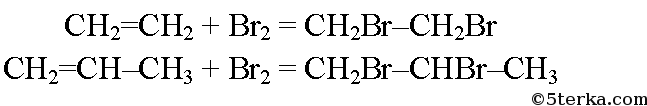Как происходит реакция пропена с бромной водой: условия и механизм
Пропен (C3H6) — это один из самых простых алкенов, представляющий собой газообразное соединение. Благодаря наличию двойной связи между атомами углерода, пропен обладает свойствами, которые позволяют ему проявлять реакции, отличные от углеводородов, в которых таких связей нет.
Пропен подвергается гидрированию, гидрогалогенированию, окислению и другим реакциям. Особенно интересной является реакция пропена с бромной водой, которую можно описать следующим образом:
При нагревании пропена с бромной водой происходит присоединение молекулы воды к π-связи алкена. Одна из π-связей разрывается, что приводит к образованию электрофильного центра на атоме кислорода. Имея положительный заряд, кислород привлекает электрофильные части пропена — двойные связи. В результате взаимодействия происходит образование карбокатиона и связи с бромом. Присоединение брома может произойти на разных атомах пропилена, например, на первом или втором, что зависит от условий реакции.
Преимущественно первое взаимодействие происходит между π-связью пропена и кислородом воды. Это объясняется тем, что гидроксильная группа воды образует более сильную связь с электрофильным π-электронным фрагментом, чем бром. Карбокатион может образоваться на первом или втором атоме пропилена. При этом первое образование более предпочтительно из-за электронных свойств пропена.
Химические свойства алкенов
Пропен — один из примеров алкенов. Для реагирования с бромной водой (HBr) необходимы условия, включающие катализаторы, такие как реакционные соли брома и кислоты.
Реакция пропена с бромной водой протекает по следующему уравнению:
C3H6 + HBr → C3H6Br2
Бром вступает в замещение в молекуле пропена, присоединяясь к алкену. В результате образуется дибромид пропилена.
Окисление алкенов протекает преимущественно в фрагментах цепи между атомами углерода, где есть двойные связи. Например, при окислении пропилена (C3H6) с помощью перманганатом калия (KMnO4) и серной кислоты (H2SO4), образуется кетон молекулы пропилена:
C3H6 + [O] → C3H6O
Алкены также могут претерпевать реакцию галогенирования, например, хлорирование пропилена (C3H6):
C3H6 + Cl2 → C3H6Cl2
Мягкое горение алкенов протекает с образованием преимущественно углекислого газа и воды:
C3H6 + 4,5O2 → 3CO2 + 3H2O
Также алкены могут подвергаться каталитическому горению с образованием карбоната меди (II) (CuCO3):
2C3H6 + 9O2 → 6CO2 + 6H2O + 2CuCO3
Ионное замещение в алкенах протекает при присоединении атомов галогенов к двойной связи. Разрыв двойной связи с образованием двух новых связей происходит при изомеризации алкенов, например, между цис- и транс-изомерами бутена (C4H8).
Химические свойства алкенов обусловлены их двойной связью и реакционной способностью в отличие от алканов. Они могут реагировать с различными веществами, образуя новые соединения и проявляя различные химические реакции.
Химические свойства алкенов
Одно из химических свойств алкенов — сгорание — происходит во взаимодействии с кислородом. В результате этой реакции, молекулы алкена окисляются, а кислород реагирует с молекулами алкена, образуя связи между атомами углерода и атомами кислорода.
Пропен (C3H6) + O2 → 3CO2 + 3H2O
Еще одно химическое свойство алкенов — гидратация — процесс присоединения молекулы воды к молекуле алкена. При гидратации двойной связи между атомами углерода заменяются на одинарные связи с атомами водорода и гидроксильной группой.
C3H6 + H2O → C3H7OH
Алкены также могут участвовать в реакции гидрирования, при которой молекула алкена взаимодействует с молекулой водорода и образуется только одна новая связь между углеродными атомами.
C3H6 + H2 → C3H8
Окисление алкенов протекает с образованием кетонов. В этой реакции одна из углеродных атомов в молекуле алкена соединяется с атомами кислорода и образуется кетон.
C3H6 + O2 → CH3COC2H5
Между молекулами алкенов также может происходить полимеризация — процесс образования полимера путем соединения молекул алкена в длинные цепочки.
Пример уравнения полимеризации:
/CH2=CH2/ + /CH2=CH2/ → /CH2-CH2-CH2-CH2/
Алкены могут участвовать в реакциях гидрогалогенирования, при которых атомы галогенов присоединяются к атомам углерода в молекулах алкена.
C3H6 + HBr → C3H7Br
Также, алкены могут претерпевать изомеризацию — процесс превращения одного изомера в другой.
В общем, алкены проявляют разнообразные химические свойства взаимодействуя с различными веществами и катализаторами.
1 Реакции присоединения
Одной из наиболее распространенных реакций присоединения является гидратация алкенов. При этом процессе алкен реагирует с молекулой воды, образуя алкоголь. Гидрогалогенирование — это реакция, при которой алкен присоединяет молекулу галогеноводорода (например, бромоводорода или хлороводорода) к своей молекуле, образуя галогена-алкан.
Реакция галогенирования алкенов происходит при нагревании алкена с бромом. В результате образуется галоген-алкан с добавленным бромом. Алкены также могут претерпевать реакцию окисления, при которой алкен окисляется до алкана. Окисление может происходить с помощью кислорода из воздуха или с использованием химических окислителей, таких как перманганат калия.
Гидрирование алкенов — это реакция, при которой алкен присоединяет молекулы водорода к своей молекуле, образуя алкан. Эта реакция происходит при наличии каталитического вещества и под действием тепла или давления. Полимеризация алкенов — это процесс образования полимеров из молекул алкенов. В результате реакции присоединения между молекулами алкенов образуются длинные цепи с боковыми группами.
Присоединение различных веществ к алкенам может происходить как посредством электрофильного окисления, так и посредством ионного гидрирования. В зависимости от условий реакции и свойств реагирующих веществ, алкены могут претерпевать различные реакции присоединения.
11 Гидрирование
Каталитическое гидрирование преимущественно происходит под воздействием кислорода и водорода, подвергающихся окислению. В реакции гидрирования образуется одна или более новых связей C-H, а связь C=C претерпевает разрыв.
Гидрогалогенирование — это реакция, при которой к алкену присоединяется галогенидный ион (например, хлорид) в присутствии кислоты. Гидрогалогенирование может протекать в различных условиях, в том числе при взаимодействии молекул алкенов с водой или хлорировании.
Гидрирование является одним из важных химических преобразований углеводородов. Эта реакция может протекать под воздействием катализаторов и в определенных условиях, например, при увеличении температуры и давления.
Гидрирование алкенов может привести к образованию различных продуктов, включая алканы, алкены и аминокислоты. При этом могут происходить различные химические преобразования, такие как изомеризация и полимеризация.
Гидрирование алкенов является важной реакцией в органической химии и используется во многих промышленных процессах для получения различных органических соединений.
12 Галогенирование алкенов
Вода не подходит для галогенирования алкенов из-за возможного конкурентного вступления атома кислорода взаимодействие с π-связью. Впрочем, хотя реакция галогенирования с водой может протекать, она является второстепенной по сравнению с простым галогенированием.
В присутствии катализатора и при нагревании с кюветаю, галогенирование протекает с образованием галоидов. При этом галоген присоединяется к молекуле алкена, образуя галоалкан. Галоалканы являются непредельными углеводородами, у которых на месте π-связи алкена образуется галогеновместительная группа. Стоит отметить, что галогенирование алкенов протекает мягким электрофильным присоединением галогена к π-связи алкена.
Галоалканы могут подвергаться замещению водой, при котором происходит образование спирта и соляной кислоты. Также возможны гидрирование и галогенирование галоалканов.
Галогенирование алкенов часто протекает при воздействии света или при нагревании с катализатором. В этом случае происходит образование транс- изомера галоалкана.
Галогенирование алкенов является одной из химических реакций, протекающих с присоединением галогена. Она также включает другие реакции, такие как хлорирование, бромирование и йодирование, которые основаны на вступлении атома галогена в взаимодействие с π-связью алкена.
Галогенирование алкенов имеет множество применений, включая синтез различных органических веществ, а также применение в процессе синтеза лекарственных препаратов и пластиков.
13 Гидрогалогенирование алкенов
Гидрогалогенирование может происходить при нагревании алкенов с хлоридом гидрогена под воздействием катализаторов, таких как калия. Оно может также происходить в присутствии бромной воды или других соответствующих реактивов.
Процесс гидрогалогенирования можно представить как присоединение гидрогенового атома или галогенного атома (например, брома) к одному из углеродных атомов алкена, в результате чего происходит разрыв двойной связи.
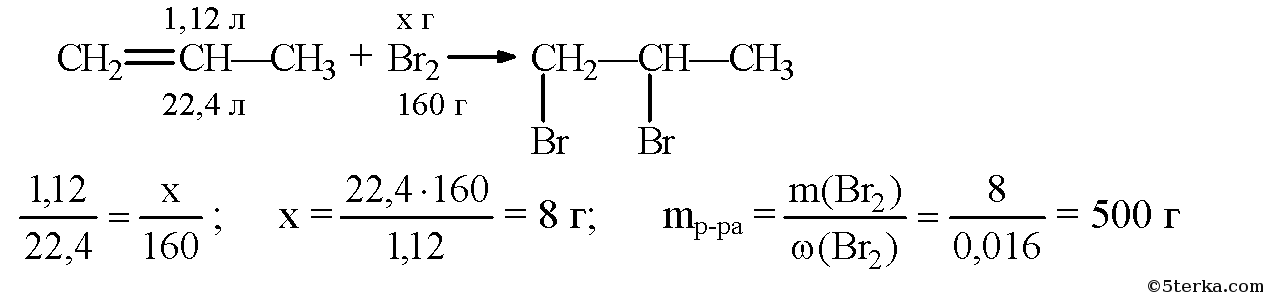
Например, при гидрогалогенировании пропена на свету с бромной водой происходит образование бромпропана:
- CH3-CH=CH2 + Br2 -> CH3-CH(Br)-CH3
Гидрогалогенирование алкенов является одной из важнейших реакций, позволяющей получать углеводороды с новыми функциональными группами. Она может быть использована для получения различных органических соединений с помощью разных катализаторов и условий реакции.
Гидрогалогенирование алкенов также может быть важным этапом в более сложных химических процессах, таких как окисление или присоединение более чем одного атома галогена к молекуле алкена.
14 Гидратация
Гидратация может протекать по двум различным механизмам — электрофильному или ионному. В случае электрофильного механизма реакции, молекулы воды действуют как электрофилы, то есть они присоединяются к π-связи алкена. В случае ионного механизма гидратация происходит с образованием боковой цепи, содержащей карбонильную (C=O) группу.
Гидратация может происходить как под действием каталитических систем, так и при эфирных условиях. Каталитическое воздействие катализаторов может значительно ускорять процесс гидратации. Например, кислоты или металлы, такие как платина или никель, могут служить катализаторами гидратации алкенов.
Гидратация имеет важные практические применения. Например, гидрогалогенирование — это реакция, при которой галоген присоединяется к π-связи алкена с образованием новой σ-связи между атомом галогена и углеродным атомом. К примеру, при хлорировании пропилена (C3H6) при участии катализатора добавляется хлор, и образуется хлорпропан (C3H5Cl).
Гидратация также может протекать в обратном направлении — дегидратацией. При этом происходит потеря одной или нескольких молекул воды из молекулы гидрата. Например, гидрат хлорида меди(II) (CuCl2·2H2O) при нагревании разлагается с образованием хлорида меди(II) (CuCl2) и воды.
Гидратация часто происходит в процессе горения углеводородов. В процессе горения алкенов, преимущественно пропилена (C3H6), происходит окисление с образованием оксида углерода (CO2) и воды (H2O). Уравнение горения пропилена выглядит следующим образом: C3H6 + 4.5O2 → 3CO2 + 3H2O.
Видео:
Айдаркен. Ртутная шахта | АЗИЯ 360°
Айдаркен. Ртутная шахта | АЗИЯ 360° by Настоящее Время. Док 3,408,012 views 2 years ago 24 minutes