- Взаимодействие солей с водой: механизмы и реакции
- Гидролиз – реакция обмена между солью и водой
- Гидролиз солей сильных оснований и слабых кислот
- Гидролиз солей слабых оснований и слабых кислот
- Все химические реакции, необходимые для успешной сдачи ОГЭ
- Правило 11 Обменные реакции в растворах
- 146 Реакции ионного обмена
- 1. Реакция обмена кислоты и основания
- 2. Реакция обмена металла
- 3. Реакции амфотерного гидроксида
- Видео:
- ВОДОЛЕЙ 💐 20-26 ноября 2023
Взаимодействие солей с водой: механизмы и реакции
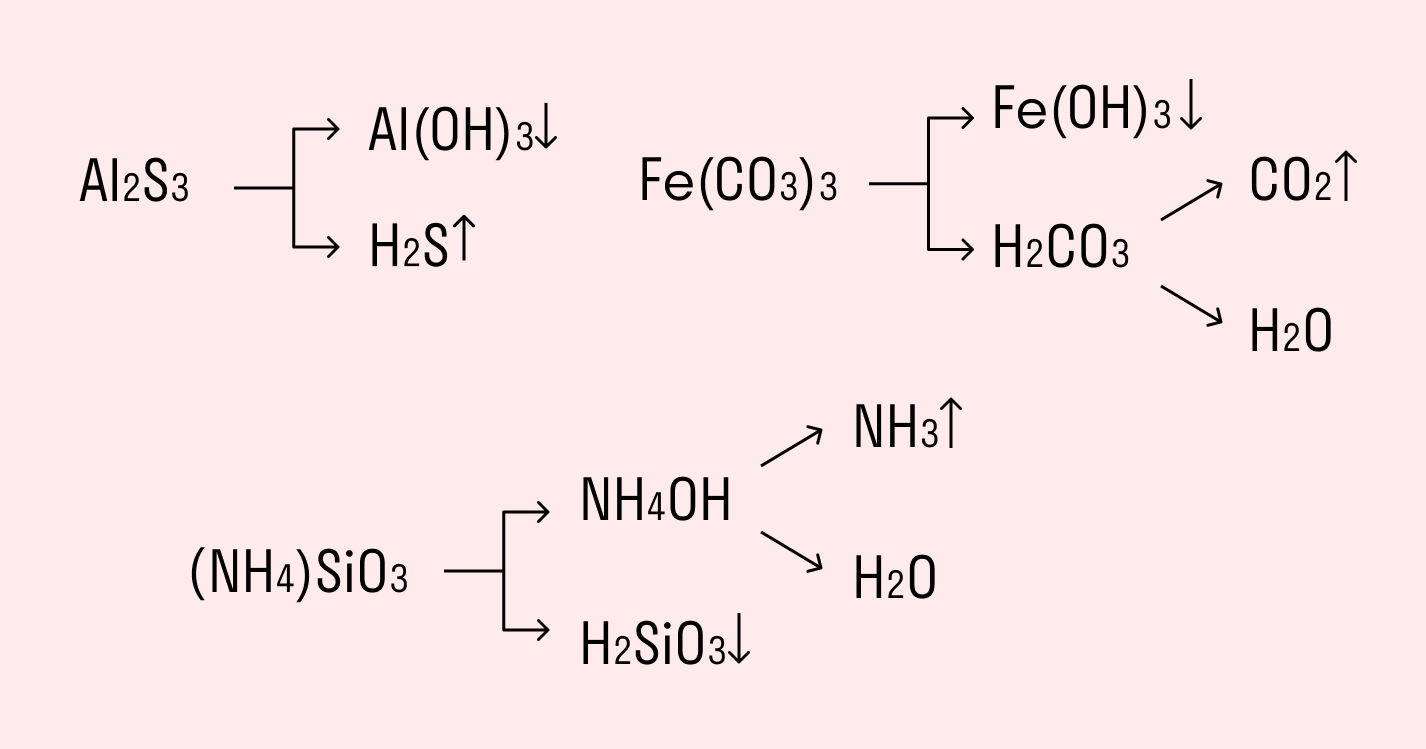
Реакции обмена солей с водой являются основой многих химических процессов. В химии эти реакции называются гидролизом. Если вещество является солью, то оно состоит из ионов металла и ионов кислоты или основания. Когда такая соль растворяется в воде, происходит разделение на эти ионы.
Гидролиз может проходить как с солями сильных кислот и слабых оснований, так и с солями слабых кислот и сильных оснований. В первом случае ионы воды преимущественно взаимодействуют с ионами кислоты, образуя гидроксиды металла и ионы во втором случае – с ионами основания, образуя кислоту и ионы гидроксода металла.
Важно отметить, что при гидролизе солей слабых кислот и слабых оснований обе ионные формулы подвергаются гидролизу, а значит, в реакции принимают участие оба компонента соли и вода. В таком случае, чтобы записать уравнение реакции гидролиза, нужно учесть оба уравнения гидролиза исходных ионов.
Гидролиз – реакция обмена между солью и водой
Гидролиз солей сильных оснований и слабых кислот
Если вода образует кислотные ионы более сильные, чем основные, то гидролиз будет протекать в виде реакции с молекулами воды, в результате чего раствор будет иметь кислую среду.
Рассмотрим следующую реакцию гидролиза соли натрия из хлористым железа (III) для более ясного представления:
FeCl3 + 3H2O → Fe(OH)3 + 3HCl
Видно, что в результате гидролиза основания железа (III) не полностью превращаются в гидроксид железа (III), а вода образует соляную кислоту. Как видно из уравнения, гидроксид железа является слабым основанием, а хлорид — сильным кислотным гидридом.
Гидролиз солей слабых оснований и слабых кислот
Когда основание слабее, а кислота также слабая, гидролиз будет протекать с образованием солевых оснований и капельной кислоты. При этом оксид в молекулярном виде (например, углекислый газ) также может образовываться в результате гидролиза.
Например, рассмотрим гидролиз соли натрия, такой как Na2CO3, который образуется из слабой кислоты – угольной, и слабого основания – карбоната натрия:
Na2CO3 + H2O → 2NaHCO3
Уменьшаем уравнение:
CO32- + H2O ↔ HCO3— + OH—
Таким образом, в результате гидролиза образуется солевая основа и капельная кислота.
Заметите, что энергия окислительно-восстановительных реакций может быть использована для успешной реакции гидролиза солей водой. В реакции гидролиза соли железа (III) с водой гидроокись Fe(OH)3 является окислителем, а вода является восстановителем. Таким образом, происходит восстановление Fe3+ в Fe2+.
В результате гидролиза солей с водой, продуктами реакции могут быть гидроксиды или солевые основания (если основания сильные), капельные кислоты и газы (если основания слабые) или соединения, вызванные окислительно-восстановительными реакциями. Гидролиз является важной реакцией, необходимой для понимания химических процессов в растворимых электролитах.
Все химические реакции, необходимые для успешной сдачи ОГЭ
При изучении реакций обмена солей с водой, особое внимание уделяется процессам гидролиза, которые играют важную роль в химии и позволяют понять, как происходят химические превращения в растворах.
Основой гидролиза являются основания и кислоты. Следует отметить, что химическое соединение, полученное из основания и кислоты с образованием воды, это соль.
Одной из реакций обмена солей с водой является реакция натрия с водой. В результате этой реакции образуется гидроксид натрия (NaOH) и водород (H2). Уравнение реакции можно записать следующим образом:
2Na + 2H2O → 2NaOH + H2
Более сложной является реакция обмена соли меди(II) хлорида (CuCl2) с натрием (Na). В результате такой реакции образуется гидроксид меди(II) (Cu(OH)2) и соль натрия (NaCl). Уравнение реакции выглядит так:
2Na + CuCl2 → Cu(OH)2 + 2NaCl
Помимо гидролиза, для успешной сдачи ОГЭ необходимо знать другие реакции обмена солей с водой. Важное правило, которое следует запомнить — растворимая соль в воде распадается на ионы силными основаниями и кислотами.
Таким образом, если в среде сильной кислоты гидроксид распадается на ионы металла и ионы гидроксида, то в среде сильного основания распадается на ионы металла и ионы аньона кислоты, то есть на кислотные остатки. Особенности образования ионного обмена при гидролизе можно выразить следующей формулой:
МНО(m)+bOs -> Мm(OH)b + образование кислоты
где М — металл, b — число молекул воды, Ос — основание, m — заряд катиона, образование кислоты протекает по окислительно-восстановительному механизму.
Таким образом, все химические реакции, перечисленные выше, необходимы для успешной сдачи ОГЭ и помогут понять процессы обмена солей с водой. Запомните эти формулы и правила, и вы сможете справиться с заданиями, связанными с реакциями обмена солей.
Правило 11 Обменные реакции в растворах
При обменных реакциях в растворах происходит взаимодействие ионов растворенных солей с ионами воды. В результате этого взаимодействия образуются новые соединения — гидролизные продукты. Гидролиз — это реакция воды с раствором, в результате которой образуются ионы гидроксида и ионы водорода или гидроксидное основание и ионы водорода.
Обменные реакции в растворах можно представить уравнениями реакций, в которых справа от стрелки записываются гидролизные продукты. Уравнения гидролиза чаще всего записывают с использованием сокращенных обозначений солей и воды.
Примеры обменных реакций:
- NaCl + H2O → NaOH + HCl
- Pb(NO3)2 + H2O → Pb(OH)2 + HNO3
- FeCl3 + H2O → Fe(OH)3 + HCl
Заметите, что во всех примерах наблюдается образование осадка — гидроксида металла. Гидроксиды металлов имеют характерное свойство рыхлого белого осадка.
Отметим также, что в растворах сильных кислот или оснований гидролиз осадков преимущественно не происходит, и образование гидроксида металла происходит полностью.
Правило 11 указывает на то, что обменные реакции в растворах оснований должны происходить полное образование гидроксида металла, а обменные реакции с кислотами — только гидролиз с образованием ионов гидроксида и гидроксидного основания.
Для гидролизных реакций важно учитывать также энергию реакций. Например, если в растворе находятся ионы Fe3+, а также ионы H+, то реакция гидролиза железа будет идти окислительно-восстановительных свойствах. В результате гидролиза происходит окисление Fe3+ до Fe2+, а одновременно и восстановление H+ до H2. Получившееся вещество — Fe(OH)3 — амфотерный оксид. Это значит, что Fe(OH)3 может проявлять как кислотные, так и основные свойства в зависимости от условий среды.
В лабораторных условиях гидролиз можно наблюдать, капельную реакцию, в результате которой образуется белый осадок гидроксида металла.
146 Реакции ионного обмена
В результате реакций ионного обмена образованные вещества могут быть растворимыми или нерастворимыми в воде. Все реакции ионного обмена можно представить в виде уравнений.
Рассмотрим примеры реакций ионного обмена:
1. Реакция обмена кислоты и основания
Реакции обмена кислоты и основания происходят при взаимодействии исходных кислот и оснований. В результате такой реакции образуется соль и вода. Например:
- 2HCl + NaOH → NaCl + H2O
- H2CO3 + 2NaOH → Na2CO3 + 2H2O
2. Реакция обмена металла
Реакции обмена металла происходят при взаимодействии металла с раствором соли другого металла. В результате такой реакции образуется соль первого металла и металл восстанавливается. Например:
- CuCl2 + 2Ag → 2AgCl + Cu
- FeCl3 + 3Cu → 3CuCl2 + Fe
3. Реакции амфотерного гидроксида
Амфотерный гидроксид — это вещество, которое может выступать и в качестве кислоты, и в качестве основания. При реакциях амфотерного гидроксида с кислотами или щелочью образуются соли.
Например:
- Al(OH)3 + 3HCl → AlCl3 + 3H2O
- Cu(OH)2 + 2NaOH → Cu(OH)2 + 2H2O
- Ca(OH)2 + 2HNO3 → Ca(NO3)2 + 2H2O
Таким образом, реакции ионного обмена являются одной из основных групп реакций в химии. Они происходят между электролитами и включают в себя образование растворимых и нерастворимых солей, а также восстановление металлов.
Видео:
ВОДОЛЕЙ 💐 20-26 ноября 2023
ВОДОЛЕЙ 💐 20-26 ноября 2023 by Ilona Tarot 613 views 13 hours ago 22 minutes