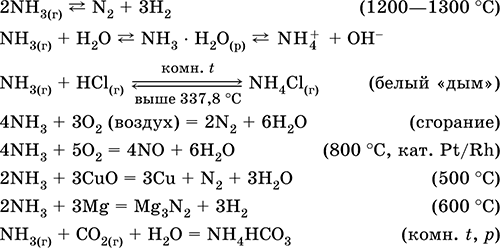
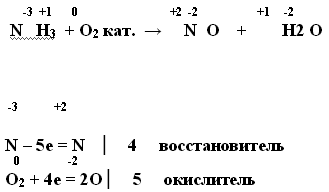Что происходит при реакции аммиака с водой и какие продукты образуются?
Аммиачная реакция с водой – одна из загадок химии, которую ученые изучают уже веками. При контакте аммиака с жидкой водой возникает особая химическая реакция, в результате которой появляется растворимый соединение – аммиачная соль. Зависимость между объемом аммиака и воды в этой реакции позволяет получить водородные ионы и гидроксиды, делая аммиачную реакцию с водой активным основанием.
Для реакции аммиака с водой используют катализатор – воду, которая растворена в реагентах. Именно вода позволяет электронам в аммиаке стать более активными, образуя ионы и гидроксиды при контакте с растворителем. Водный раствор аммиака также используют для получения аммиачных гидроксидов и солей, а также в качестве основания при различных химических реакциях.
Реакция аммиака с водой происходит при температуре, близкой к кипению воды. Это значит, что при нормальных условиях образуется растворимый аммиачный осадок. Поэтому степень растворимости аммиака в воде зависит от температуры и давления.
В результате реакции аммиака с водой образуются аммиачные гидроксиды, которые растворяются в воде, образуя щелочные растворы. Самопроизвольная реакция между аммиаком и водой основана на перемещении электронной плотности. Когда атомы аммиака взаимодействуют с молекулами воды, образуется аммиачная связь и возникают сильные щелочные свойства реагентов.
Итак, реакция аммиака с водой – это процесс, при котором атомы аммиака переходят в раствор, образуя гидроксиды. Водородные ионы и гидроксиды, полученные в результате этой реакции, широко применяются в разных областях химии, медицины и промышленности.
Реакция аммиака с водой: что образуется
Реакция аммиака с водой происходит в зависимости от концентрации аммиака и температуры. При высоких концентрациях аммиака и низких температурах реакция протекает быстро и образуется щелочное растворное соединение. В противном случае, реакция может протекать медленно или не полностью.
Аммиачная реакция с водой характерна для щелочных соединений и оснований. Аммиак является слабой основой, поэтому его реакция с водой происходит в соответствии с уравнением:
| NH3 + H2O | → | NH4+ + OH— |
|---|
В результате этой реакции образуется аммиачная соль. Эта реакция также может происходить в обратном направлении, когда аммиачная соль растворяется в воде и образует аммиачные и гидроксидные ионы.
Аммиачная реакция с водой может быть использована для определения присутствия аммиака в растворах. Для этого обычно используется фенолфталеин — индикатор щелочности. В присутствии аммиака раствор приобретает красный цвет.
Реакция аммиака с водой также является важным экологическим аспектом. Аммиак используется в больших количествах в сельском хозяйстве, при производстве удобрений и чистящих средств. Выпуск аммиака в окружающую среду может вызывать загрязнение воды и атмосферы, поэтому необходимо контролировать его использование и утилизацию.
§ 24 Аммиачная вода
| CH3COOH + NH3 | CH3COO— + NH4+ |
Растворы аммиачной воды проявляют химические и физические свойства, зависимые от степени диссоциации аммиака в воде. Аммиачная вода имеет основоподобные свойства и применяются в медицине, животноводстве и растениеводстве.
В видеоопыте видно, что аммиака – это газообразное соединение, которое имеет характерный цвет. При контакте с водой образуются гидроксид и аммоний. Растворы аммиачной воды используются в качестве азота в химических процессах и в производстве удобрений. Отличительной особенностью аммиачной воды является ее способность растворяться в воде с образованием щелочного раствора.
Вода, насыщенная аммиаком, имеет особый запах. Она долго стоит вещество, поэтому должна храниться в плотно закрытой упаковке.
Аммиачная вода в чистом виде добавляют в растворы для более существенного изменения pH, исключительно аккуратно. Это требуется, так как растворы аммиачной воды могут привести к повреждениям кожи, глаз и органов дыхания. Дополнение аммиачной воды позволяет получить качественное осаждение, так как аммиачная вода является сильным основанием.
Аммиачная вода имеет множество применений в различных областях, включая химию, медицину и промышленность. В животноводстве аммиачная вода используется для дезинфекции и очистки животных помещений. В растениеводстве аммиачная вода используется для подкормки растений и улучшения их роста.
Аммиак получение и свойства
Синтез аммиака имеет особое значение в химической промышленности, так как он является основным компонентом производства азотной кислоты, аммиачной селитры и других химических соединений.
Свойства аммиака отражают его химическую структуру и связи между атомами. Молекула аммиака состоит из одной атома азота (N) и трех атомов водорода (H), связанных между собой. Связи между атомом азота и водорода являются координационными или σ-связями.
Несмотря на то, что аммиак имеет основные свойства оснований, его реакция с водой не так проста. Когда аммиак растворяется в воде, происходит реакция с образованием аниона гидроксида (OH-) и ионов аммония (NH4+). Эта реакция является обратимой, что означает, что аммиак может быть обратно выделен из раствора.
Реакция аммиака с водой может быть представлена следующим уравнением:
NH3 + H2O ⇌ NH4+ + OH-
Основание, образуемое при реакции аммиака с водой, можно найти в различных жидких и газообразных растворах. Например, в водном растворе аммиака присутствуют ионы аммония и ангидрид гидроксида.
Физические свойства аммиака включают его острый запах и способность растворяться в воде. Запах аммиака вызывается аммиакальными связями, содержащими электроны, не участвующие в межатомных связях.
Аммиак также является характерным основанием и может реагировать с кислотами, образуя соли. Это свойство аммиака связано с его способностью принимать протоны (H+) от кислоты.
Аммиак получают путем нагревания аммиакальной соли (например, соляного хлорида или нитрата аммония) с щелочью, такой как гидроксид натрия или гидроксид калия. Эта реакция происходит при высоких температурах и является обратимой.
Аммиачные соединения также могут быть получены путем каталитического окисления азота в присутствии активного катализатора. Этот процесс, известный как процесс Хабера, широко применяется в промышленности для производства синтетического аммиака.
Таким образом, аммиак является важным химическим соединением, обладающим множеством химических и физических свойств. Его получение и свойства представляют интерес и значимость для химической промышленности, а также для научных исследований.
Видео:
Аммиак NH3 и аммоний NH4, нитриты NO2 и нитраты NO3 в воде аквариума. Азотный цикл в воде.
Аммиак NH3 и аммоний NH4, нитриты NO2 и нитраты NO3 в воде аквариума. Азотный цикл в воде. by Дипир Аквариумы 15,514 views 2 years ago 9 minutes, 42 seconds