- Уравнение реакции между бензолом и бромной водой: как происходит реакция и что образуется
- Химия 10 класс
- § 20 Химические свойства получение и применение бензола
- Химические свойства бензола
- Химические свойства аренов
- Химические свойства аренов
- 1 Реакции присоединения
- 11 Гидрирование
- 12 Хлорирование аренов
- 2 Реакции замещения
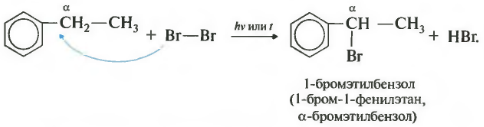
- 21 Галогенирование
- 22 Нитрование
- 23 Алкилирование ароматических углеводородов
- Видео:
- Химические свойства бензола и его гомологов. 1 часть. 11 класс.
Уравнение реакции между бензолом и бромной водой: как происходит реакция и что образуется
Реакция бензола с бромной водой является одной из важнейших ароматических замещений в органической химии. Бензол (C6H6) — это циклический углеводород, содержащий шесть ароматических колец в своей структуре. В химии он известен своей особенной устойчивой структурой и реакционной активностью.
При реакции бензола с бромной водой, один из его водородных атомов замещается атомом брома. Уравнение реакции представляет собой образование галоген-замещенного бензола. Такой замещенный бензол может быть использован в дальнейших химических превращениях и синтезе органических соединений.
В условиях данной реакции, при наличии катализаторов (например, перманганата калия) и обычно при повышенной температуре, происходит замещение в бензоле одного из его водородных атомов атомом брома (Br). Образуется соединение, содержащее ароматическое кольцо и внутреннюю цепь с атомом брома.
Химия 10 класс
В 10 классе учащиеся изучают различные аспекты химии, включая ароматические соединения. Особенности ароматических углеводородов, включая их свойства и реакции, составляют важную часть программы.
Ароматические углеводороды, такие как бензол, являются не только частями многих органических соединений, но и обладают рядом уникальных свойств. Например, углеродные атомы в бензоле образуют кольцо, которое называется ароматическим. Это кольцо взаимодействует с внешними заместителями, такими как алкилы или галогены, и может быть замещено в разных положениях.
Одной из реакций, которую можно изучить в рамках курса химии 10 класса, является алкилирование бензола. В результате этой реакции, одна из водородных связей в бензольном кольце замещается алкильной группой. Алкилирование может происходить с использованием различных алкиловых заместителей, таких как метил или этил. Присоединение алкила к ароматическому кольцу осуществляется в альфа-положении относительно других групп.
Кроме алкилирования, бензол может реагировать с другими заместителями, такими как галогены, серная кислота или концентрированные кислоты. Нитрование бензола – это реакция, при которой в бензоловом кольце в альфа-положение к ароматической системе присоединяется нитрогруппа (–NO2). В результате этой реакции образуется нитробензол.
Особенности ароматических соединений могут быть продемонстрированы также в реакции с хлором. Хлорирование бензола – это реакция, при которой в бензольном кольце замещается одна из водородных связей хлором. В результате реакции образуется хлорбензол.
Кроме реакций замещения, другие свойства ароматических соединений можно изучить в рамках курса химии 10 класса. Например, ароматические соединения обладают способностью гидрироваться и окисляться. Гидроксил атом может быть присоединен к ароматическому кольцу в присутствии катализаторов, таких как платина или никель. Ароматические соединения могут подвергаться также окислительной реакции. Например, бензол может окисляться до бензойной кислоты в присутствии сильных окислителей, таких как концентрированные кислоты или перманганат калия.
На уроках химии 10 класса учащиеся также знакомятся с понятием гомологов аренов. Гомологи аренов – это серия ароматических соединений, отличающихся друг от друга на одну и ту же массу молекулярной формулы (например, толуол, ксилол, этилбензол и т.д.). Гомологи аренов обладают общей основной структурой, что позволяет ученикам изучить закономерности в их свойствах и реакциях.
Таким образом, в рамках курса химии 10 класса учащиеся знакомятся с различными аспектами ароматических соединений. Это включает изучение реакций замещения, таких как алкилирование, нитрование и хлорирование бензола. Также рассматриваются другие свойства ароматических соединений, включая их возможность гидрирования и окисления. Знание этих особенностей ароматических углеводородов позволяет ученикам лучше понять их структуру и реакционные возможности.
§ 20 Химические свойства получение и применение бензола
- Бензол обладает реакционной способностью ароматических углеводородов, что обусловлено наличием ароматической системы пиэлектронов.
- Бензол образует бензойну, полное окисление которой приводит к образованию диоксида углерода и воды.
- При взаимодействии бензола с бромнорасщепляющими реагентами (бромной водой) происходит гидролиз бензолной соли с образованием соответствующего кислотного радикала.
- В результате замещения атомов водорода в бензоле атомами хлора, брома или йода в присутствии сильных галогенирования, образуется галогенопроизводное бензола.
- Гидрирование бензола может проявляться в присутствии каталитических систем под действием высокого давления водорода и высокой температуры.
- Бензол может окисляться за присутствия солей хлора, с resulting in образованием преимущественно его этилбензола.
- При нагревании бензола в присутствии горения, возможно образование атомов хлора, которые вступают в реакцию с бензолом.
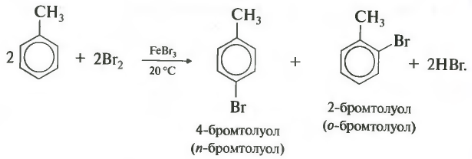
- Орто- и пара-дибромбензолы получают путем замещения бензолу атомами брома в реакции галогенирования бензола в присутствии хлорида железа(III).
- При образовании оксидов соединения бензола, хлорирование бензола можно провести при нагревании на солнце.
- Бензол может присоединяться взаимодействию не только с галогены, но и с другими заместителями.
Таким образом, бензол обладает разнообразными химическими свойствами, которые позволяют его использовать в различных областях промышленности и науки.
Химические свойства бензола
Взаимодействие бензола с хлором, бромом и йодом протекает при нагревании или при присутствии хлорной или бромной воды в присутствии феррохлорида (FeBr3) или феррической серной (Fe2(SO4)3). В результате таких реакций происходит замещение одного или более атомов водорода в бензольном ядре атомами галогена.
Бензол также может подвергаться нитрованию в нейтральной среде при взаимодействии с смесью концентрированной серной кислоты и концентрированной азотной кислоты. В результате получается гидроксонитробензол (C6H5NO2).
Одной из особенностей бензола является его способность к гидрированию и алкилированию. В результате гидрирования бензола образуется циклогексан (C6H12), а при алкилировании бензол может образовывать различные замещенные производные, такие как этилбензол (C6H5C2H5) или толуол (C6H5CH3).
Бензол также может претерпевать гомологию, то есть образовывать серию соответствующих производных, в которых заместитель находится в позиции альфа к бензольному ядру. Например, толуол содержит метильную группу (CH3) в позиции альфа к бензольному ядру.
| Тип реакции | Уравнение реакции |
|---|---|
| Гидрирование | C6H6 + 3H2 → C6H12 |
| Алкилирование | C6H6 + C2H5Cl → C6H5C2H5 + HCl |
| Нитрование | C6H6 + HNO3 → C6H5NO2 + H2O |
Бензол также может реагировать с кислородом в присутствии катализатора, например, перманганатом калия (KMnO4), и образовывать бензойную кислоту (C6H5COOH).
Сильными окислителями, такими как хромовая кислота (H2CrO4), бензол может превращаться в фталевую кислоту (C6H4(COOH)2).
Орто- и па-позиции ароматического кольца бензола являются особенно реакционноспособными и могут подвергаться замещению или взаимодействию с различными реагентами.
В результате всех этих реакций бензол проявляет свои химические свойства и способен образовывать различные замещенные производные, что делает его важным сырьем и реагентом в органическом синтезе.
Химические свойства аренов
Бензол обладает рядом химических свойств, включая замещение атомов в кольце. При замещении одного или нескольких атомов водорода могут образоваться различные заместители. Например, при замещении одного атома водорода атомом хлора образуется хлорбензол, а при замещении атомов водорода группой Метил, образуется Толуол.
Ароматические соединения, такие как бензол, могут проходить различные химические реакции, включая окисление, гидрирование, сульфирование и другие. Например, бензол может окисляться кислородом или серной кислотой, при этом образуется бензойная кислота. При гидрировании бензола под действием водорода образуется циклогексан.
Ориентирующее замещение происходит в альфа-положении, если замещающая группа находится вблизи одной из двух атомов углерода в кольце. Для этого в реакции могут использоваться катализаторы, такие как железо(III) хлорид (FeBr3).
Арены могут также гореть в виде смеси с воздухом, если концентрированных оксидов металлов. Этот процесс называется горение аренов. Также арены могут подвергаться процессу сульфирования, при котором атомы водорода замещаются сульфоны.
В химии арены имеют широкое применение. Например, они используются в производстве различных химических соединений, таких как стирол, используемые при производстве пластмасс и резиновых изделий. Также арены могут быть использованы в процессах химической синтеза при получении различных органических соединений.
| Химическая реакция | Пример |
|---|---|
| Гидрирование | Бензол + водород -> Циклогексан |
| Окисление | Бензол + кислород -> Бензойная кислота |
| Сульфирование | Бензол + сульфоны -> Сульфокислота |
Химические свойства аренов
Химические свойства аренов определяются возможностью их замещения в реакциях с другими веществами. Бензол и другие арены образуют стабильные соединения при взаимодействии с различными заместителями и функциональными группами.
Под воздействием сильных кислот, таких как концентрированные кислоты, арены могут подвергаться процессам ацилирования и алькилирования. В результате таких реакций образуются соединения, в которых на место водородного атома бензольного кольца вступает кислота или заместитель.
Одним из примеров таких реакций является реакция бензола с бромной водой. В условиях этой реакции, бензол проходит протекает с бромной водой, образуя бензойную кислоту. Уравнение этой реакции:
C6H6 + Br2 + H2O → C6H5COOH + HBr
Еще одним примером является реакция бензола с нитрующей смесью, в результате которой образуется нитро-группа (-NO2) на бензольном кольце:
C6H6 + HNO3 + H2SO4 → C6H5NO2 + H2O
Арены также могут образовывать соединения при взаимодействии с другими гомологами бензола, такими как галогены и аминогруппы. Примером такой реакции является присоединение мета-хлортолуола к бензолу:
C6H6 + C7H7Cl → C6H5C7H8Cl
Также арены могут подвергаться окислению при нагревании с калийперманганатом или другим окислительным веществом. В результате образуются соединения с функциональными группами, такими как гидроксильная группа (OH). Например:
C6H6 + KMnO4 → C6H5OH + MnO2 + K2CO3
Таким образом, химические свойства аренов определяются их способностью к замещению и образованию новых связей с другими веществами, что делает арены важными соединениями в органической химии.
| Условия реакций | Продукты реакций |
|---|---|
| Под действием концентрированных кислот | Соединения с кислотой или заместителем |
| Взаимодействие с другими гомологами бензола | Соединения с галогенами или аминогруппами |
| Окисление нагревании с окислителями | Соединения с гидроксильной группой |
1 Реакции присоединения
Реакции присоединения представляют собой связывание атомов или групп атомов перманганатом, хлора или других химических веществ с молекулами бензола или других ароматических углеводородов. Эти реакции могут протекать при нагревании, под действием света или при присутствии сильных окислителей.
Одной из таких реакций является реакция бензола с бромной водой. При этом в результате взаимодействия бромной воды с бензолом образуется мета-хлортолуол. Вторым продуктом реакции является гидробромная кислота. Уравнение реакции выглядит следующим образом:
C6H6 + Br2 + H2O → C6H4Cl2 + HBr
Другая реакция присоединения – это действие концентрированных растворов кислотного окислителя, например, соляной кислоты, на бензол. В результате этой реакции образуется хлорбензольная кислота. Уравнение реакции принимает вид:
C6H6 + 3 HCl → C6H5Cl + H2
Также, бензол может присоединяться к другим агентам, например, гидрированию, что приводит к получению толуола, или при горении, когда образуется углекислый газ.
Реакции присоединения могут происходить в различных позициях бензольного кольца. В случае преимущественного присоединения второго водорода – это альфа-положение. Атомы или группы атомов замещения могут быть размещены в мета- и позиции бензольного кольца.
Реакции присоединения в ароматических соединениях сохраняются из-за наличия двойной связи между атомами углерода в бензольном кольце. Тем не менее, реакции с присоединением могут протекать только при наличии специальных условий – концентрированных реагентов или катализаторов, например, железа.
Плотность присоединения атомов к бензолу может зависеть от реакционных условий и химических свойств исходных веществ. Некоторые реакции присоединения ведут к образованию только одного продукта, в то время как другие могут приводить к образованию нескольких продуктов.
Реакции присоединения в ароматических соединениях имеют большое значение для получения различных органических веществ. Они также позволяют изучить химические свойства и реакционную способность этих соединений.
11 Гидрирование
Бензол может претерпеть гидрирование при взаимодействии с водородом в присутствии катализаторов, таких как платина или ранений. В результате гидрирования бензол превращается в циклогексан. Уравнение реакции гидрирования бензола выглядит следующим образом:
| Реагенты | Продукты |
| Бензол (C6H6) | Циклогексан (C6H12) |
| + | |
| Водород (H2) |
Гидрирование бензола – это один из методов получения циклогексана, который может использоваться, например, в процессе производства пластмасс и резины.
12 Хлорирование аренов
Хлорирование аренов, также известное как галогенирование ароматических углеводородов, представляет собой реакцию, в которой атомы водорода в кольце заменяются атомами хлора. Этот процесс обладает своими особенностями и находит применение в получении различных заместителей в органической химии.
В соответствии с действием хлора на арены, протекает реакция хлорирования, в результате которой в кольце образуется хлорированный продукт. Уравнение этой реакции может содержать окисление, присоединение гидроксил- или нитро-группы, нагревание, действие света и другие факторы.
Преимущественно для хлорирования ароматических углеводородов используется хлор и его единицу измерения 4. Однако, хлорирование аренов может происходить также и с действием других галогенированных соединений, таких как бром и йод.
Хлорирование аренов, включая хлорирование бензола, может протекать при использовании сильных окислителей, таких как серная кислота, гидроксид калия или перклорат калия. Такой подход позволяет получить высокие выходы хлорированных продуктов. В особенности нитрование аренов может происходить в присутствии окислителей под воздействием света.
Хлорирование аренов имеет свои особенности и зависит от класса ароматических углеводородов. Например, хлорирование толуола может привести к образованию 2,4-дихлортолуола или других хлорированных продуктов. Важно отметить, что процесс хлорирования аренов может быть обратимым, и хлорированные продукты могут легко дехлорироваться.
Классический метод получения хлорированных аренов заключается в использовании хлора и проксидов металлов, таких как пероксид водорода или пероксид марганца. Однако, наряду со стандартными методами, существуют и альтернативные подходы, такие как электрохимическое хлорирование, плазменное хлорирование и другие.
Хлорирование аренов является важным этапом в получении различных органических соединений, таких как хлорированные растворители или промежуточные продукты для синтеза новых исходных материалов. Для дальнейшей обработки хлорированных аренов могут применяться такие методы, как гидрирование, нитрование, окисление или их комбинации.
В свете высокой химической активности и опасности хлорированных аренов, важно соблюдать все меры предосторожности при работе с ними. Они могут быть горючими, взрывоопасными и токсичными веществами, поэтому необходимо соблюдать все правила и рекомендации по их безопасному обращению.
2 Реакции замещения
При взаимодействии с бромной водой у бензола, под действием высокого давления и железа в присутствии сульфата, происходит замещение одного из атомов водорода на атом брома. В результате этой реакции образуются продукты, которые являются гомологами аренов: бромбензол и гидробромидная кислота.
При реакции бензола с хлором или другими галогенами происходит замещение одного или нескольких атомов водорода на атомы галогенов. Таким образом, образуется серия гомологичных ароматических соединений.
Вторым типом реакций замещения является алкилирование бензола. При этой реакции в результате присоединения алкиловой группы к бензольному кольцу образуется новый продукт — ароматический углеводород. В присутствии хлорида железа, арены могут присоединять эти группы либо орто, либо парадиоксипозиции, а также на других позициях.
Сульфирование бензола происходит при взаимодействии бензола с серной кислотой в присутствии концентрированной серной кислоты. При этой реакции атом серы присоединяется к бензольному кольцу, образуя продукты сульфирования.
Общая химическая формула гомологов аренов имеет вид C6H6nH2n+1. Примерами гомологов аренов являются толуол (n = 1), ксилол (n = 2), мезитол (n = 3) и др. Второй группой гомологических соединений являются стирол и его гомологи. Они образуются при присоединении алкиловых групп к стирольному кольцу.
В результате замещения атомов водорода на другие радикалы возникает общая цепь, сохраняется высокая устойчивость бензольного кольца к горению и другим химическим реакциям.
21 Галогенирование
При галогенировании бензола в хлористом растворе мы наблюдаем появление бурого кольцевого осадка. При этом в растворе образуется соляная кислота.
| Реакция | Уравнение реакции |
|---|---|
| Галогенирование бензола хлором | К6Н12 + 6НСl → С6Н5Сl + 6Н2О |
Галогенирование бензола хлором преимущественно происходит в мета-положении относительно уже присутствующих заместителей, таких как нитро-группа или аминогруппа. Если в системе имеется только одна такая группа, то она замещается атомом хлора. Если же есть несколько подобных групп, то они замещаются последовательно. В результате реакции образуется мета-хлортолуол.
Взаимодействие бензола с хлорной водой в присутствии кислоты происходит без огня и взрыва, что делает эту реакцию безопасной в промышленности. Для ускорения процесса галогенирования может использоваться катализатор. Также можно провести галогенирование бензола в условиях ароматического замещения. При этом бензол вступает в реакцию с халоген-кислотой с образованием галогенбензойной кислоты.
Окисление бензола может происходить в присутствии сильных окислителей, таких как хромовая смесь, соляная кислота или концентрированный азотнокислый калий. При этом на месте бензольного ядра образуется карбоновая кислота.
| Реакция | Уравнение реакции |
|---|---|
| Окисление бензола хромовой смесью | С6Н6 + НО + К2Cr2O7 → НСО2К + Cr2О3 + Н2О |
Вторичное галогенирование может происходить в присутствии хлора или брома при присутствии катализатора. При этом связь между атомами углерода в кольце все больше замещается заместителями. Также может образоваться двойная связь между углеродами, что делает возможным получение алкенов из углеводородов.
Галогенирование – это важный класс реакций, при которых в системе молекулы присутствуют кислотовосстановительные свойства и возможность образования хлористых и бромистых заместителей. В результате галогенизации происходит замещение одной или нескольких атомов водорода атомом галогена.
22 Нитрование
Процесс нитрования бензола происходит при действии нитрирующей смеси, которая содержит концентрированную плавящую серную кислоту (H2SO4) и концентрированный азотную кислоту (HNO3). Реакция нитрования бензола может быть представлена следующим уравнением:
C6H6 + HNO3 + H2SO4 → C6H5NO2 + H2O + H2SO4
Сульфирование — это химическая реакция, при которой кольцо ароматической серии углеводородов замещается группой серы (-SO3H). Сульфирование бензола происходит при взаимодействии бензола с концентрированной серной кислотой (H2SO4) в присутствии некоторых окислителей. Реакция сульфирования бензола может быть представлена следующим уравнением:
C6H6 + H2SO4 → C6H6SO3H
23 Алкилирование ароматических углеводородов
Алкилирование ароматических углеводородов представляет собой реакцию, в результате которой происходит присоединение алкильной группы к ароматическому кольцу. Это второй по значимости и распространенности вид реакций ароматических соединений, после галогенирования. Алкилирование позволяет получать различные замещенные ароматические соединения, которые обладают различными свойствами и находят применение во многих областях химии.
Одной из наиболее широко используемых реакций алкилирования ароматических углеводородов является реакция алкилирования бензола. В присутствии кислоты Фриделя-Крафтса (алюминий хлорид) и алкилгалогенида (например, этила хлорида), происходит замещение одного из водородных атомов на ароматическом кольце алкильной группой, с образованием алкилбензола.
Уравнение реакции алкилирования бензола:
| C6H6 + C2H5Cl → C6H5CH2Cl + HCl |
Итак, в результате данной реакции алкилирования бензола с этила хлоридом образуется этилбензол и соляная кислота.
Алкилирование ароматических углеводородов имеет несколько особенностей по сравнению с другими реакциями ароматических соединений. Во-первых, в присутствии кислоты Фриделя-Крафтса образуется хлоридов алкилбензольных соединений, которые обладают устойчивостью к действию сильных окислителей и кислот и хорошо растворяются в органических растворителях. Во-вторых, реакция алкилирования ароматических углеводородов происходит при нейтральной или слабощелочной среде.
Алкилирование ароматических углеводородов является важным методом получения различных алкилбензольных соединений, которые находят широкое применение в органическом синтезе, в производстве лекарственных препаратов, пластиков и других материалов.
Видео:
Химические свойства бензола и его гомологов. 1 часть. 11 класс.
Химические свойства бензола и его гомологов. 1 часть. 11 класс. by МЕКТЕП OnLine ХИМИЯ 19,962 views 3 years ago 15 minutes