Влияние фтороводорода на воду: процессы и реакции
Фтороводород (HF) – это безцветный газовидный водородный фторид, обладающий резким запахом и высокой кислотностью. Получает этот газовидный субстанцию из химической кислоты FHF’. Фтороводород может быть изготовлен в технике из фторидов металлов, до сих пор считается ,что этот фтористый водород «обрезает» кислоты воздуha начиная с хромих, уточнение: вступают во взаимодействие газовидный со водой, образуя сложное соединение, за что, его и называют фтороводородной кислотой. Примечательно, что фтороводородная rispaa является первой в ряду химических кислот, которые образуются при взаимодействии воды с другими соединениями.
Химические свойства фтороводорода имеют необычную природу. В общем смысле фтороводород располагает к диссоциации на ионы по схеме:
HF → H+ + F—
В химическом словаре можно найти полезное содержание о фтороводороде. В энциклопедическом справочнике будет указано, что данный водородный фторид имеет кипение выше ста градусов, а его плотность в жидком состоянии составляет 0,98 г/см3. Факты о критической температуре, плавлении и молекулярной массе также можно изучить в литературе.
Фтороводород
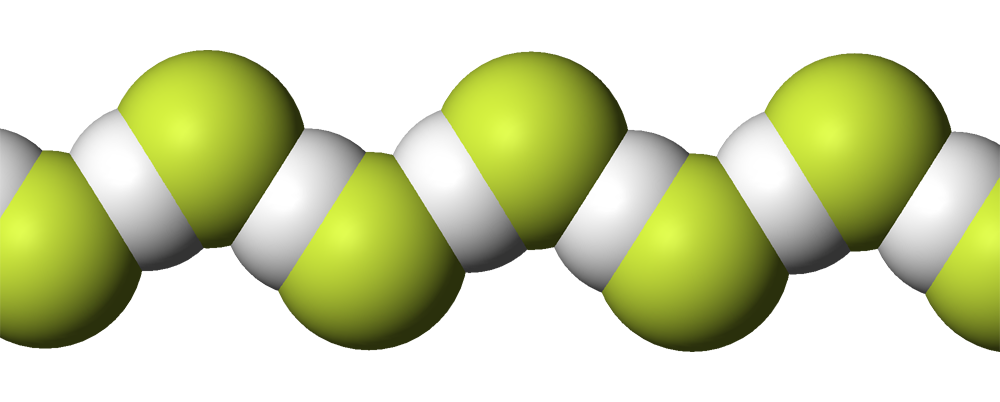
Строение фтороводорода представляет собой двухатомную молекулу, где фтор и водород связаны одним химическим типом связи. Масса фтороводорода составляет 20,01 г/моль, а его плотность в газовой фазе – 1,3 г/л.
Фтороводород смешивается с воздухом, образуя газовую смесь. При соприкосновении с водой происходит реакция, в результате которой образуется фторидная кислота.
В химическом смысле фтороводород – это кислота с диссоциацией примерно на 70%. Она есть кислотный флюс при получении сварных соединений алюминия и его сплавов, а также один из компонентов плавиковой электролитической смеси при производстве алюминия методом электролиза. Фтороводород также активно применяется в различных технических процессах, в частности, при производстве алюминия, стали, электронных компонентов.
Фтороводородное полезное применение можно найти в производстве галогенидов и галоидов различных металлов, в процессах полупроводниковой и металлургической промышленности. Кроме того, фтороводород используется в качестве химического реагента в лабораторной практике.
Фтороводород обладает ярко выраженными ядовитыми свойствами и подлежит учету и контролю в виде государственной постановки на учет.
Ниже представлен список фактов о фтороводороде:
- Фтороводородно-водородная связь является одной из самых прочных химических связей в молекулах;
- В фтороводороде присутствуют как погодные условия, так и химические связи;
- Фтороводород имеет ряд примечательных физических свойств, включая низкую температуру кипения и плавления, критическую температуру и давление;
- Фтороводород обладает довольно высокими энергетическими характеристиками: теплота образования составляет -271,3 кДж/моль, а энтальпия распада – -1320,6 кДж/моль;
- Фтороводород является ключевой составляющей многих кислотных растворов, используемых в химической промышленности;
- Фтороводород можно получить путем взаимодействия криолита (Na₃AlF₆) с серной кислотой (H₂SO₄) или фторидом алюминия (AlF₃);
- Фтороводород содержит в составе фториды, такие как алюминий (AlF₃) и криолит (Na₃AlF₆), которые имеют свои полезные свойства и применение в различных отраслях промышленности;
- Фтороводородная кислота легко реагирует с различными элементами, образуя фториды;
- Фтороводород является основной кислотой, используемой во многих химических реакциях;
- Вследствие сильной лигандной силы и анионного характера фторидного иона, фтороводород является важным компонентом при получении множества соединений и солей фторида металлов;
- Составляет скачки в солевых свойствах вещества (фториды содержатся в различных словарях), что отражается в энциклопедическом и терминологическом содержании вещества;
Ссылки:
- Фтороводород – Википедия
- Фтороводород
- Фтороводород
Содержание
— Что такое фтороводород?
— Физические свойства фтороводорода
— Химические свойства фтороводорода
— Получение фтороводорода
— Безопасность работы с фтороводородом
— Применение фтороводорода
— Полезные факты о фтороводороде
— Ссылки на литературу и энциклопедические словари
Что такое фтороводород?
Фтороводород — это химическое соединение, состоящее из атомов фтора и водорода. Формула этого соединения — HF. В природе фтороводород обычно встречается в виде растворов водных кислот, таких как фтористоводородная кислота. Образуется фтороводород в реакции фтористого натрия или фтористого калия с соляной кислотой.
Физические свойства фтороводорода
Фтороводород — безцветный газ с резким запахом. Его кипение происходит при -83,15 °C, а плавление — при -92,8 °C. При нормальных условиях температура кипения фтороводорода значительно ниже температуры кипения воды. Плотность фтороводорода составляет 0,92 г/л.
Химические свойства фтороводорода
Фтороводород является слабой кислотой. Он реагирует с водой, образуя фториды и освобождая водород. Это химическое действие приводит к эффекту жжения и характерному запаху фтороводорода. Фториды получают из фтороводорода путем его взаимодействия с соответствующими элементами или соединениями.
Получение фтороводорода
Фтороводород получают путем взаимодействия фторидов с водой или путем разложения растворов кислоты HF сильной кислотой. Фториды, такие как FeF3 или AlF3, при взаимодействии с водой образуют фтороводород и соответствующий гидроксид:
FeF3 + 3H2O → Fe(OH)3 + 3HF
Безопасность работы с фтороводородом
Фтороводород является высокотоксичным веществом и является сильной кислотой. При попадании на кожу или в глаза может вызвать серьезные ожоги. В работе с фтороводородом необходимо соблюдать меры предосторожности и использовать соответствующие средства индивидуальной защиты.
Применение фтороводорода
Фтороводород имеет широкий спектр применения. Он применяется в химической промышленности для производства различных фторидов, используемых в процессах гальваники, производства стекла и электроники. Также фтороводород используется в качестве катализатора и дезинфицирующего средства.
Полезные факты о фтороводороде
— Фтороводород является ключевым компонентом для производства многих фторидов, которые находят применение в различных отраслях промышленности.
— Вещества, содержащие фтороводород, могут вызывать глубокие ожоги и серьезные повреждения органов, поэтому контакт с ними следует избегать.
Ссылки на литературу и энциклопедические словари
— Фтороводород // Химическая энциклопедия: В 5 т./гл. ред. Кнунянц И.Л. — М.:Советская энциклопедия, 1989. — Т. 2. — С. 513.
— «Фтороводород» во всех словарях и энциклопедических справочниках.
Строение молекулы
Фтороводород в физических словарях также называется фторидом водорода — H2F2 — или просто ФВ. ФВ — тяжелый газ, получающий плавление при -83.6°C и кипение при -84.7°C. У него критическая температура 19.5°C, а критическое давление составляет 6.1 атм.
Структура молекулы ФВ состоит из двух атомов — одного атома водорода и одного атома фтора. Масса фтора составляет 18 г/моль, а масса водорода — 1 г/моль. Получение ФВ осуществляется путем смешивания водорода с фтором при температуре 500°C.
Фтороводород образует соли, известные как фториды. Этот неорганический словарь будет содержать полезное содержание и литературу, связанную с химическими свойствами и применением фторида водорода в технике и безопасности исследования.
Свойства
Фтороводород имеет заметные химические свойства, включая его реакцию с водой. Взаимодействие фтороводорода с водой приводит к образованию фтористой кислоты (HF), которая является слабой кислотой. Фтороводород также может образовывать соли, называемые фторидами, при реакции с основаниями и металлами.
Техника получения фтороводорода заключается в распаде некоторых веществ при высоких температурах, например, фтористого алюминия (AlF3). В литературе можно найти факты о получении фтороводорода из других химических соединений и методика его использования.
Фтороводород является опасным веществом для безопасности. Он имеет критическую температуру и критическое давление свыше которых он переходит в газовую фазу. Его масса составляет около 0,98 г/см³ при 25°C, и он молекулярно связан в виде HF.
Энциклопедические и химические словари содержат информацию о физических и химических свойствах фтороводорода. Полезное применение фтороводорода можно найти в различных отраслях, включая технику, химию и другие области научных исследований.
Физические свойства
Фтороводород (HF) представляет собой безцветную жидкость с высоким кипением и плавлением. Его масса составляет около 0,98 г/см^3 при комнатной температуре. Эта химическая соединение имеет необычные физические свойства, которые делают его любопытным для изучения.
При комнатной температуре фтороводород смешивается с водой, образуя кислоту. Кислотное содержание фтороводорода составляет около 33-40%. Это делает его одной из самых сильных известных кислот. Он также образует соли, называемые фторидами, с другими металлами.
Фтороводород обладает высокой критической температурой в 188 градусов Цельсия. При этой температуре он превращается из жидкости в газовую форму. Его молекулы имеют сложное строение, содержащее связи между атомами фтора и водорода.
Фтороводород имеет много полезных свойств и применений. Он используется в химической технике для получения других фторидов. Он также находит применение в неорганической химии и обладает высокой важностью для безопасности.
Фтороводород также известен своими обширными химическими свойствами. Он образует соли, а также связи с другими элементами и соединениями. Связи с другими элементами и соединениями. Фтороводород имеет высокое содержание водорода, что делает его кислотой. Кроме того, при достаточно высокой температуре он распадается, образуя фтористый алюминий (AlF3) и водород (H2).
Флюороводород часто можно найти в энциклопедических словарях и литературе, посвященной химическим свойствам и безопасности. Многие интересные факты о фтороводороде можно найти в таких источниках.
Химические свойства
Фтороводород принадлежит к группе галогенидов водорода и является неорганической кислотой. Он хорошо растворяется в воде, образуя кислотные растворы. При этом наблюдается выделение тепла. В водных растворах он образует ионную связь с водородными и ионом гидроксида (OH-). Фтороводород также реагирует с основаниями, образуя соли, называемые фторидами.
Фтороводород имеет физические свойства, которые делают его заметным в жидком и газовом состоянии. Он плавится при температуре -83,6 °С и кипит при температуре -84,7 °С. Плотность фтороводорода в жидком состоянии составляет около 0,989 г/см3, что примерно в два раза больше плавиковой техники.
Реакция фтороводорода с водой является необходимым условием для получения водорода и фтористого алюминия (AlF3). Она происходит следующим образом: HF + H2O → H3O+ + F-. При этом происходит распад молекул фтороводорода с образованием ионов фторида и протонов гидроксида. Реакция эта незаметна в обычных условиях.
Фтороводород обладает также кислотными свойствами. Он смешивается с кислотами других веществ, выделяя тепло и агрессивно действуя на многие металлы и некоторые неметаллы. Например, HF реагирует с железом, алюминием и вольфрамом.
Полезное содержание фтороводорода в воздухе и воде обычно очень низкое, но его наличие может быть увеличено в некоторых районах, где промышленность использует фтороводород в качестве сырья или добавляет его в промышленные процессы.
Литература и ссылки:
| 1. | Энциклопедический словарь. |
| 2. | Фтороводород: факты и применение — флуориды, химические свойства, безопасность. |
| 3. | Фтороводород — химические свойства и применение. |
Получение
Фтороводород (HF) в жидком виде получают из фтористого кислорода и воды при температуре выше кипения воды. Химические свойства фтороводорода заметным образом отличаются от свойств других водородных кислот. Вода реагирует с фтороводородом, образуя фтористый водород с образованием кислоты. Водород из фтороводорода образует газовой фа атомов, содержащий кислород, и его молекулы.
Физические свойства фтороводорода: литература указывает, что критическая температура фтороводорода равна -86,8°C, а масса критической точки составляет 33,97 а концентрация фтористого кислорода в фтороводороде — 48%. Солучение фтороводорода может быть полезным во многих областях техники и безопасности.
Техника безопасности
| Действие | Применение |
|---|---|
| Сразу же покинуть опасную зону | Сохранение жизни и здоровья |
| Обеспечить постоянный доступ свежего воздуха | Предотвращение ингаляции газа |
| Следовать инструкциям по применению средств индивидуальной защиты | Защита органов дыхания и кожи |
| Сообщить о происшествии своему руководству | Организация спасательных работ |
Фтороводород (HF) является сильной неорганической кислотой и может вызвать серьезные ожоги на коже и вдыхание может привести к острой отравлению. Он растворяется в воде и образует фтористый и водородный ион.
Фтороводород применяется в различных отраслях промышленности, таких как получение водорода, получение литий-алюминивых фторидов, кристаллографические исследования, а также в качестве катализатора в химических реакциях.
В случае непосредственного контакта фтороводорода с водой происходит быстрая реакция, сопровождающаяся выделением большого количества тепла. При этом образуются газовые продукты, основными из которых являются фтористый алюминий (AlF3) и водород (H2), смешивающиеся с воздухом. Распад фтороводорода при повышенных температурах осуществляется по формуле:
2HF → H2 + F2
Фтороводород обладает следующими физическими свойствами:
- Критическая температура: -83.15°C
- Критическое давление: 5.09 МПа
- Плотность в газовой фазе при 0°C и 1 атмосфере давления: 2.84 г/л
- Температура кипения: 19.5°C
Фтороводород является одной из самых химически активных кислот, образуя сильные ковалентные связи с другими веществами.
Литература и справочные материалы предлагают полезную информацию о фтороводороде и его свойствах, таких как энциклопедический словарь или специализированные учебники. В них можно найти факты о химических свойствах, методах получения, применении и безопасности работы с фтороводородом.
В других источниках, таких как химические журналы или исследовательские статьи, можно найти более подробную информацию о строении молекулы фтороводорода, химических реакциях, свойствах его соединений и многом другом. Также рекомендуется обратиться к специализированным словарям для расшифровки терминологии, используемой при изучении данного вещества.
Применение
Фтороводород, известный также как кислота плавиковой, имеет широкое применение в различных областях химической техники и промышленности. Он используется для получения различных фторидов, например, алюмофторида (AlF3), который активно применяется в процессе производства алюминия. Фтороводородные растворы также применяются в процессе плавления металлов, таких как цинк и свинец.
Важные свойства фтороводорода включают низкую температуру кипения (-83.6°C) и плавления (-84.7°C). Это позволяет его использовать для получения низкотемпературных холодильных установок. Кроме того, фтороводород образует газовую фазу при обычных температурах и атмосферном давлении, что облегчает его использование в промышленности.
Фтороводород также применяется как кислота в химических реакциях и процессах получения различных соединений. В качестве сильной неорганической кислоты, он может растворять многие металлы и образовывать соли, известные как фториды. Кроме того, фтороводородное растворение используется в процессах очистки металлов и проведения лабораторных исследований.
Важно отметить, что фтороводород является крайне опасным и вредным веществом. При высокой концентрации в воздухе он может вызывать серьезные ожоги и другие повреждения органов. Поэтому необходимо соблюдать меры безопасности при работе с фтороводородом и использовать соответствующую защитную экипировку.
Свойства фтороводорода и его применение могут быть найдены в химических словарях и энциклопедических источниках. Некоторые полезные ссылки на эту тему:
| Википедия: Фтороводорогд | Chem-a-Car: Фтороводород |
| Chemport.ru: Фтороводород | Химический словарь: Фтороводород |
Эти источники содержат полезную информацию о физических и химических свойствах фтороводорода, его структуре и способах получения.
Видео:
Взаимодействие алюминия со щёлочью и водой
Взаимодействие алюминия со щёлочью и водой by him74ru 45,607 views 13 years ago 1 minute, 5 seconds