Взаимодействие оксида никеля с водой: как происходит реакция и какие продукты образуются
Оксид никеля (II) – химическое соединение элемента никеля с кислородом, обычно представленное формулой NiO. В природе он встречается в виде тёмно-зелёного вещества. У него имеются такие физические свойства, как высокая температура плавления (около 1985°C) и плохая проводимость электричества. Оксид никеля (II) часто используется для получения различных соединений никеля и имеет широкое применение в различных областях промышленности.
Одним из наиболее известных соединений никеля является реакция оксида никеля (II) с водой. При контакте с водой образуется гидроксид никеля (II), обозначаемый как Ni(OH)2. Эта реакция включает несколько химических зависимостей, таких как содержание никеля, температура и pH среды.
Оксид никеля (II) обладает высокой активностью в реакции с водой, и его свойства сильно зависят от концентрации и pH раствора. В результате реакции образуется гидроксид никеля (II) в виде тонкого осадка. Это соединение обладает ярким цветом и широко используется в процессе получения других оксидов никеля, а также в качестве катализатора в различных химических реакциях.
Важно отметить, что при реакции оксида никеля (II) с водой образуется большое количество тепла, поэтому данная реакция может протекать с высокой интенсивностью. Также следует учитывать, что оксид никеля (II) является токсичным веществом и может быть опасным для окружающей среды. Поэтому необходимо соблюдать все меры предосторожности при работе с ним.
Оксид никеля II
Получение
Оксид никеля II можно получить путем нагревания никеля в присутствии кислорода при температуре выше 400 градусов Цельсия. Этот процесс называется окислением.
Свойства
Оксид никеля II обладает различными физическими и химическими свойствами.
Физические свойства:
- Цвет: тёмно-зелёный.
- Содержание никеля: около 78%.
Химические свойства:
- Встречается в природе в виде минерала никелита.
- Реакция с водой: оксид никеля II реагирует с водой, образуя гидроксид никеля II.
- Взаимодействие с кислотами: оксид никеля II реагирует с кислотами, образуя соответствующие соли никеля.
Применение
Оксид никеля II находит применение в различных областях. Например, он используется в качестве катализатора в химических реакциях. Также его применяют для получения других соединений никеля.
Соединения оксида никеля II имеют свойства, которые делают их полезными для различных промышленных процессов. Например, они могут быть использованы в производстве керамики, электродов, керамики с полупроводниковыми свойствами и других материалов.
Безопасность
Оксид никеля II является безопасным соединением при правильном обращении и использовании. Однако, при работе с ним необходимо соблюдать меры предосторожности, так как никель и его соединения могут быть токсичными при вдыхании, попадании на кожу или проглатывании.
Сноски:
- Научное название оксида никеля II — оксид никеля (II).
- Альтернативное название оксида никеля II — никель(II) оксид.
- Оксид никеля II также может быть назван диоксидом никеля.
Содержание
- Оксид никеля и его свойства
- Физические свойства оксида никеля
- Химические свойства оксида никеля
- Зависимость свойств оксида никеля от температуры
- Получение оксида никеля
- Применение оксида никеля
- Безопасность при работе с оксидом никеля
- Оксид никеля в природе и его свойства
- Соединения оксида никеля
- Ацетиль-кофермент А
Физические свойства
Оксид никеля(II) (NiO) – химическое соединение никеля с кислородом. Это тёмно-зелёное соединение имеет высокую температуру плавления и плохо растворимо в воде. Элемент никель представлен в периодической системе под номером 28.
Физические свойства оксида никеля(II) зависят от его структуры и свойствами связей между атомами. Он обладает хорошей электропроводностью при высоких температурах и при растворении в кислотах.
Оксид никеля обладает специфическим запахом, обусловленным его химическим составом. Никель в природе обычно встречается в виде различных соединений, включая оксиды.
Получение оксида никеля(II) можно осуществить путем нагревания никельного порошка или провода в присутствии кислорода. Оксид никеля обладает высокой термической стабильностью при высоких температурах, что делает его полезным материалом в различных приложениях.
Кроме того, оксид никеля(II) используется в различных химических реакциях, включая реакцию соединения с водой. Реакция оксида никеля(II) с водой приводит к образованию гидроксида никеля(II) (Ni(OH)2), который обладает собственными химическими и физическими свойствами.
Однако, оксид никеля(II) является токсичным и канцерогенным веществом, поэтому при работе с ним необходимо соблюдать меры безопасности, включая использование защитных средств и поддержание хорошей вентиляции.
Свойства оксида никеля(II) в воде:
1. Образование гидроксида никеля(II) (Ni(OH)2) в результате реакции с водой.
2. Низкая растворимость в воде.
3. Образование слоя оксидной пленки на поверхности металлического никеля при контакте с водой.
4. Уменьшение электропроводности воды при добавлении оксида никеля(II).
Применение оксида никеля(II):
1. В качестве катализатора в различных химических реакциях.
2. В производстве аккумуляторов и батарей.
3. В электронике и оптике для создания различных устройств.
4. В производстве керамики и стекла.
Сноски: НИКЕЛЬ — Содержание никеля в оксиде никеля(II) выше, чем в других оксидах никеля. acetyl — Участвует в процессе получения оксида никеля.
Получение
Для получения оксида никеля можно встретить следующую реакцию:
2 Ni + O2 → 2 NiO
При этой реакции металлический оксид никеля образуется на поверхности металлического никеля при нагревании до высоких температур.
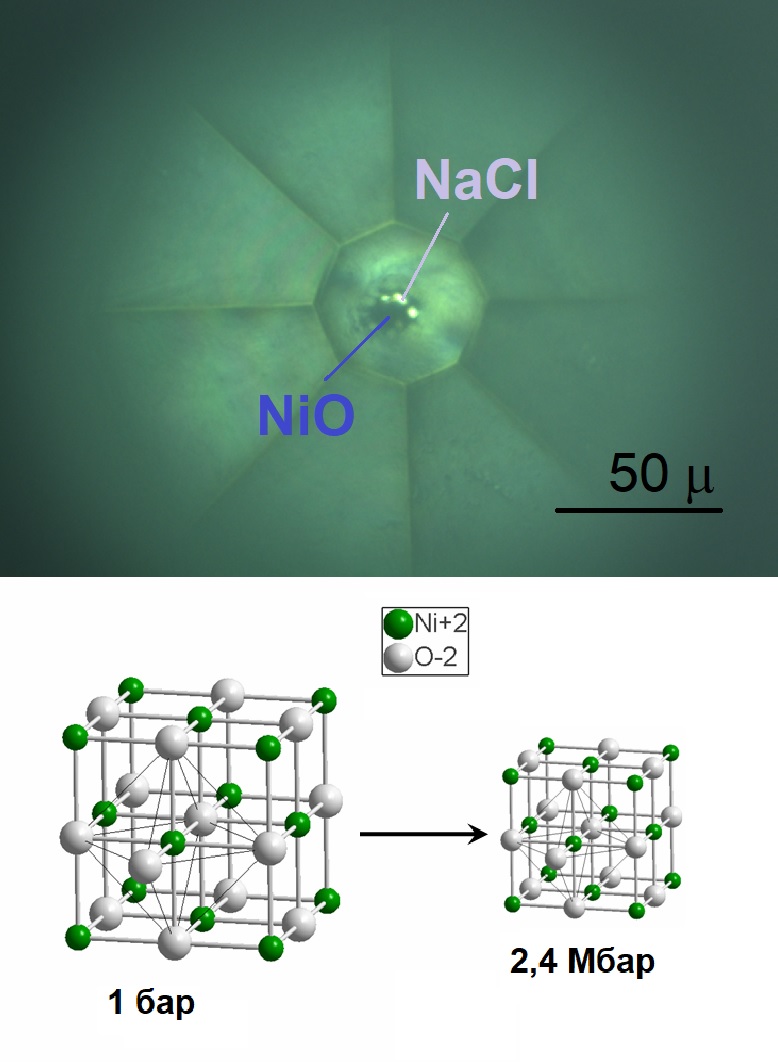
Оксид никеля(II) достаточно стабилен и имеет высокую температуру плавления (~1955 °C). Физические свойства этого соединения обусловлены его структурой и состоянием элемента никеля. В природе оксид никеля(II) встречается под формой минеральных оксидов.
Имеет применение в производстве активных катализаторов, керамики, магнетиков и электроники.
Сноски:
Acetyl: оксид никеля(II) — химическое соединение с формулой NiO и CAS номером 1313-99-1.
Химические свойства
Оксид никеля II имеет темно-зеленый цвет. В природе встречается в соединении с водой в виде Ни(OH)₂ (гидрат оксида никеля). Оксид никеля II получают при нагревании никеля или его оксида выше 400°С. Реакция оксида никеля с водой протекает с образованием гидроксида никеля II по следующему уравнению:
NiO + H₂O → Ni(OH)₂
Оксид никеля является основным оксидом никеля и обладает следующими химическими свойствами:
- При нагревании оксид никеля II образует оксид никеля III: NiO → Ni₂O₃
- Оксид никеля II образует сплавы с другими оксидами, например, с MnO, Fe₂O₃ или CoO
- Содержание оксида никеля II в соединениях зависит от pH среды
Физические свойства оксида никеля включают его температуру плавления, которая составляет примерно 1950°C, его плотность, равную 6,67 г/см³, и его молярную массу, равную 74,71 г/моль.
Оксид никеля II находит применение в различных областях, таких как производство активных углей, электродов и аккумуляторов. Также он используется в производстве электронных компонентов, катализаторов и в других отраслях промышленности. Отмечается, что соединения никеля могут быть ядовитыми и канцерогенными, поэтому необходимо соблюдать меры безопасности при работе с ними.
Сноски:
1. Химия: Учебник/под ред. Габриеляна А.В., Шелудько Н.Г. — М.: Просвещение, 2007.
2. Бутлеров А.О. Современные представления о комплексах и структуре безгидратного оксида никеля II. — Журнал физической химии, 2008, том 82, № 2, с. 364-370.
Видео:
Реакция большого количества натрия с водой.
Реакция большого количества натрия с водой. by Андрей Устинов 551,217 views 9 years ago 1 minute, 1 second