- Исследование процесса растворения хлороводорода в воде и его реакции
- Опыты по химии Соляная кислота
- Свойства хлороводорода и способы получения
- Хлороводород – что это такое формула
- Физические и химические свойства
- Взаимодействие с основаниями
- Способы получения область применения
- Техника безопасности
- Видео:
- Получение ХЛОРОВОДОРОДА. Реакция ХЛОРИДА НАТРИЯ и КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТЫ. Опыты по химии
Исследование процесса растворения хлороводорода в воде и его реакции
Хлороводород (HCl) — одна из наиболее известных кислот, которая получается в результате взаимодействия хлора и водорода. Эта химическая реакция имеет большое значение в химии и промышленности, а также находит свои применения в медицине и технике.
При взаимодействии хлороводорода с водой происходит образование соляной кислоты (HCl), которая обладает резким запахом и является одной из самых сильных кислот. Уравнение реакции имеет следующий вид: HCl + H2O → H3O+ + Cl-
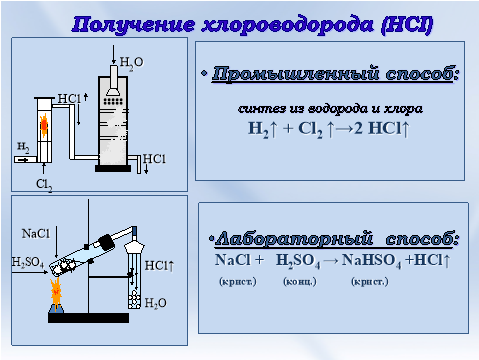
Стоит отметить, что получение хлороводорода является одной из наиболее распространенных химических реакций. В лабораторных условиях для получения этого газа используют штатив и специальную трубку, в которую подают хлористый аммония (NH4Cl) и концентрированную серную кислоту (H2SO4). Реакция происходит при нагревании смеси, в результате чего выделяется газ HCl.
Опыты по химии Соляная кислота
Соляная кислота обладает множеством химических свойств и может реагировать с различными веществами. Взаимодействие с металлами приводит к образованию солей. Например, при взаимодействии с медью она образует хлорид меди (CuCl2) и выделяется водород:
Cu + 2HCl → CuCl2 + H2
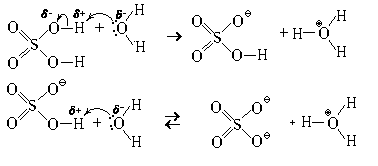
С помощью соляной кислоты также можно получить хлороводород — газ с резким запахом. Для этого проводят реакцию растворения хлорида натрия (NaCl) в соляной кислоте:
NaCl + HCl → NaCl + H2O + HCl
С использованием газоотводной трубки и основного оборудования в виде штатива, можно безопасно получить хлороводород при данной реакции.
Соляная кислота имеет также применение в медицине и в различных химических процессах. Она используется для получения металлических солей, в очистке различных веществ, а также в качестве кислотности в некоторых процессах гидролиза и обмена веществ.
Соляная кислота обладает рядом характеристик. Она является сильной кислотой и реагирует с основаниями, образуя соль и воду. Сильная кислота относится к разряду ковалентных кислот и растворяется в воде. Ее реакция с водой может быть представлена уравнением:
H2O + HCl → H3O+ + Cl—
Соляная кислота также обладает азотной (окислительной) активностью, что позволяет ей реагировать с рядом веществ, например, с ртутью и многими металлами.
Такое взаимодействие с веществами и элементами позволяет применять соляную кислоту в различных областях, включая химию, медицину и промышленность. Знание свойств и реакций соляной кислоты играет важную роль для безопасности при проведении опытов и использовании данной кислоты.
Свойства хлороводорода и способы получения
Вода является лучшим растворителем хлорида водорода, поэтому большинство его свойств изучаются в присутствии этого раствора. Хлороводород в растворе образуется в результате реакции между газообразным хлоридом водорода (HCl) и водой (H₂O).
Химическая формула хлороводорода: HCl. Он состоит из атома водорода (H) и атома хлора (Cl).
Свойства хлороводорода:
| Свойство | Описание |
|---|---|
| Физические свойства | — Хлороводород представляет собой газ с резким запахом. — Он тяжелее воздуха и неплавающий в нем. — Для сохранения и изучения используются специальные газоотводные штативы или ртути сструкторы. — При нагревании воздуха образуется пылающий безопасный газочистый хлорид водорода, избегающий образования хлорсодержащих соединений. |
| Химические свойства | — Хлороводород является сильной соляной кислотой. — Он реагирует с основаниями и образует соли (например, chlorides). — Взаимодействует с металлическими штативами, вызывая их коррозию на поверхности. — Может образовывать взрывоопасные смеси с некоторыми веществами. — Хлорид водорода является безопасным легким дезинфицирующим средством, которое широко используется в различных областях, включая медицину, санитарию, серебрение и обработку фотографий. |
Способы получения хлороводорода:
| Способ | Описание |
|---|---|
| Обменная реакция | — Хлорид металла, такого как хлорид натрия (NaCl), может реагировать с сульфатом кислоты (H₂SO₄) с образованием соляной кислоты и сульфата металла (Na₂SO₄). — Уравнение реакции: NaCl + H₂SO₄ → HCl + Na₂SO₄ |
| Растворение в воде | — Способ получения хлороводорода, описанный выше. — Хлорид водорода растворяется в воде, образуя раствор соляной кислоты. |
Свойства хлороводорода и его способы получения имеют высокую значимость в химии и находят широкое применение в различных областях.
Хлороводород – что это такое формула
Хлороводород является газообразным соединением, имеет резкий запах и является ядовитым. Он широко используется в химических процессах, производстве хлора, солей и других веществ. Хлороводород также может образовываться в результате реакции соляной кислоты (HCl) с водой (H2O) или с другими веществами.
Реакция растворения хлороводорода в воде уравнением: HCl + H2O = H3O+ + Cl-. В процессе гидролиза хлороводород превращается в соляную кислоту. Взаимодействие хлороводорода с щелочами или щелочно-земельными металлами приводит к образованию солей (хлоридов).
Хлороводород широко применяется в различных отраслях промышленности. Он используется для производства пластиков, удобрений, красителей, пропеллентов, медицинских препаратов и других продуктов. Также хлороводород используется в лабораторной технике и в различных химических опытах.
| Свойства | Значение |
|---|---|
| Молекулярная формула | HCl |
| Молярная масса | 36.46 г/моль |
| Температура кипения | -85.05 °C |
| Температура плавления | -114.22 °C |
| Плотность | 1.639 г/см³ |
Физические и химические свойства
Растворение хлороводорода в воде является сильной химической реакцией. В результате этой реакции образуется соляная кислота (HCl) и вода (H2O). Уравнение реакции можно представить следующим образом: HCl + H2O → H3O+ + Cl-
Физические свойства хлороводорода включают высокую температуру кипения (-85,0 °C) и низкую температуру плавления (-114,2 °C). При комнатной температуре и давлении, хлороводород существует в виде газа. Он реагирует с воздухом, образуя белые пары кислотного газа, которые видны благодаря газовым хлопьям, образующимся при взаимодействии с водяным паром воздуха.
Химические свойства хлороводорода обусловлены его сильной кислотностью. HCl является одним из самых сильных кислотных веществ и легко реагирует с основаниями, образуя соли. Например, реакция хлороводорода с гидроксидами щелочей (оснований) приводит к образованию солей, воды и выделению тепла. Некоторые хлорстрый реагенты могут вызывать беспаловые ожоги, их использование требует особых мер безопасности.
Одной из основных реакций хлороводорода в химии и медицине является его взаимодействие с тяжелыми металлами, например, с ртутью. В результате реакции образуется ртути хлорид (HgCl2), который широко используется в процессах обработки ртути.
Хлороводород применяется в различных областях, например, в качестве растворителя в получении ковалентных соединений, в производстве соляной кислоты и хлористого водорода, а также в медицине для обработки ран.
Важно отметить, что хлороводород является сильной кислотой. При работе с ним рекомендуется использовать защитную технику, такую как пробирки или трубки, и следовать основным правилам безопасности. Контакт с кожей и глазами следует избегать.
| Химическое название | Соляная кислота |
|---|---|
| Химическая формула | HCl |
| Реакции обмена | HCl + NaOH → NaCl + H2O |
| Простые вещества | Кислород и хлор |
| Соли | Хлориды |
| Соляная кислота | H2SO4 |
| Соляная кислота | HNO3 |
| Кислота серной | H2SO4 |
Взаимодействие с основаниями
HCl + NaOH → NaCl + H2O
При этом натрий и кристаллическая вода образуются в реакции. В результате этой реакции получается соль, состоящая из натрия (Na+) и хлорида (Cl-), и молекулы воды (H2O).
Хлороводород также реагирует с основаниями других металлов, таких, как медь (Cu), цинк (Zn), алюминий (Al) и другие. При этом также образуются соответствующие соли.
Реакция растворения хлороводорода в воде происходит с образованием кислотного раствора. В результате реакции хлороизволяется и попадает в раствор в виде иона водорода (H+). Он придает кислотность раствору.
Соляные соединения, получаемые в результате взаимодействия хлороводорода с основаниями, имеют формулу MX, где M – металл, а X – отрицательный ион, например, гидроксидный ион (-OH) или другой отрицательно заряженный ион.
Соль, получающаяся в результате реакции хлороводорода с основанием, обладает способностью растворяться в воде и ионизироваться на ионы металла и отрицательные ионы, образуя соляной раствор. Такой раствор может использоваться в различных химических исследованиях и экспериментах.
Хлороводород технический, который получают с помощью химической реакции между хлористым водородом (HCl) и металлическим железом (Fe), служит важным источником хлора в химии, промышленности и быту. Он также используется для получения различных соединений, например, серной и азотной кислот, а также солей серебра (AgCl).
При взаимодействии хлороводорода с основаниями необходимо соблюдать меры безопасности. Хлороводород – одновалентная кислота, которая взаимодействует с водой, попадает в воздух при газоотводной трубкой и образует раствор с высокой кислотностью. Поэтому при проведении опытов с хлороводородом необходимо работать в хорошо проветриваемом помещении, соблюдать меры предосторожности и следовать технике безопасности.
Соляная кислота (хлороводород) получается в лабораторных условиях путем гидролиза хлористого водорода с помощью воды. В этом процессе важно контролировать физические и химические свойства веществ, учитывая их состояние, концентрацию и условия реакции.
В результате реакции хлороводорода с основаниями и гидролиза хлорида металла получают соль и воду. Это один из способов получения простых соединений, которые играют важную роль в химических исследованиях и промышленности. Взаимодействие хлороводорода с основаниями часто производят в пробирке или другой аппаратуре, используя различные техники и методы.
Способы получения область применения
HgCl2 + H2O → HCl + Hg
Также хлороводород можно получить при гидролизе соляной кислоты (HCl) по формуле:
2H2O + 2HCl → 2H3O+ + 2Cl— + H2
В уроке химии для проведения опытов обычно используется специальная техника. Для этого реакцию проводят в пробирках на штативе с использованием газоотводной трубки.
Хлороводород (HCl) является сильной кислотой. Соль, получаемая в результате реакции хлороводорода с щелочами, называется хлоридом металла.
Опыты показывают, что высокие температуры и напряжения способны интенсифицировать реакцию растворения хлороводорода в воде. Это обеспечивает получение высокой кислотности соляной кислоты.
Соляная кислота находит широкую область применения. В качестве химического реагента она используется в производстве многих соединений, например, соляных сульфатов и солей металлов. Кроме того, с помощью соляной кислоты можно получать такое вещество, как хлороводородный газ (HCl). Этот газ можно применять в различных отраслях промышленности и научных исследованиях.
Техника безопасности
Перед началом работы необходимо ознакомиться с основными правилами и условиями безопасного выполнения опытов с хлоридами и кислотами. Необходимо работать с хлороводородом только в специально оборудованной химической лаборатории или под наблюдением опытного химика. Для работы следует использовать защитную одежду, включающую халат, защитные очки и перчатки.
При проведении опытов необходимо учитывать, что хлороводород – ядовитый и крайне опасный газ. Поэтому все работы следует проводить в хорошо проветриваемом помещении или под вытяжным шкафом. Для получения чистого газа и исключения попадания жидких кислотных капель в лабораторию, используйте газоотводную трубку. Важно помнить, что хлороводород может вызвать серьезные ожоги кожи и дыхательных путей, поэтому необходимо соблюдать осторожность при обращении с ним.
При хранении растворов хлороводорода и хлористых растворов необходимо соблюдать основные условия безопасности. Содержимое необходимо хранить в хорошо закрытой и прозрачной таре, далеко от детей и источников открытого огня. Также следует избегать применения железных ёмкостей для хранения, так как хлористый газ приводит к разрушению металла.
В случае попадания капель хлороводорода на кожу или в глаза следует немедленно промыть их большим количеством проточной воды и обратиться к врачу. Придерживаясь указанных рекомендаций и соблюдая условия техники безопасности, можно избежать возникновения опасных ситуаций и провести эксперимент с хлороводородом безопасно и эффективно.
Видео:
Получение ХЛОРОВОДОРОДА. Реакция ХЛОРИДА НАТРИЯ и КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТЫ. Опыты по химии
Получение ХЛОРОВОДОРОДА. Реакция ХЛОРИДА НАТРИЯ и КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТЫ. Опыты по химии автор: ProХимия 335 переглядів 2 роки тому 1 хвилина і 21 секунда