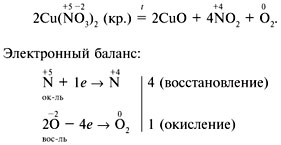- Процесс реакции гидролиза нитрата магния при контакте с водой
- Нитрат магния: способы получения и химические свойства
- Способ получения
- Щелочноземельные нитраты
- Реакция разложения нитрата магния
- Качественная реакция
- Химические свойства
- Реакции разложения
- Разложение оксидов
- Разложение нитратов
- Разложение хлоридов
- Разложение карбонатов
- Разложение гидрокарбонатов
- Разложение нитритов и сульфитов
- Разложение оксидов
- Способы разложения оксидов:
- Разложение гидроксидов
- Разложение кислот
- Разложение нитратов
- Разложение карбонатов
- Разложение хлоратов
- Разложение перхлоратов
- Разложение солей
- Разложение нитратов
- Разложение хлоратов
- Разложение хлоридов
- Разложение хлоридов с образованием гидроксидов
- Разложение хлоридов при нагревании
- Разложение нитратов
- Разложение нитратов при действии температуры
- Разложение нитратов при действии кислоты
- Разложение нитратов при действии света
- Разложение нитратов при действии других веществ
- Видео:
- Разложение нитратов
Процесс реакции гидролиза нитрата магния при контакте с водой
Образование вещества из других химических веществ — процесс, и кажется, что это магия. Но на самом деле это всего лишь результат реакции. И одна из таких реакций — разложение нитрата магния водой.
Нитраты — это соли, которые образуются из оксида металла или металлического гидроксида и азотной кислоты. И в данном случае, нитрат магния, Mg(NO3)2, разлагается образуя оксид магния (MgO), аммиак (NH3) и кислород (O2). Эта реакция очень интересна и полезна.
Разложение нитратов водой происходит благодаря разбавлению вещества водой и образованию кислоты. Разложение нитрата магния происходит в три стадии: образование оксида магния, отщепление аммиака и освобождение кислорода. При этом образуются качественные продукты: MgO, NH3 и O2.
Нитрат магния: способы получения и химические свойства
Один из способов получения нитрата магния заключается в реакции магния или его оксида с кислотой, такой как азотная кислота (HNO3). В результате этой реакции образуется нитрат магния и выделяется диоксид азота (NO2) и вода (H2O).
Еще одним способом получения нитрата магния является реакция магния с нитратом аммония (NH4NO3). При этом образуется нитрат магния и выделяется аммиак (NH3) и вода (H2O).
Нитрат магния обладает некоторыми химическими свойствами. Он разлагается при нагревании, образуя оксид магния (MgO), оксид азота (NO2) и кислород (O2). Разложение осуществляется при температуре около 500 градусов Цельсия.
Также нитрат магния может реагировать с карбонатами щелочноземельных металлов, например, с карбонатом кальция (CaCO3). В результате образуются нитрат кальция (Ca(NO3)2) и карбонат магния (MgCO3).
У нитрата магния есть качественная реакция, позволяющая его обнаружить. При добавлении к нему раствора серебра (AgNO3) образуется белый осадок нитрата серебра (AgNO3), что является характерным признаком наличия нитрата магния.
Нитрат магния также может реагировать с хлоридом алюминия (AlCl3) и образовывать нитрат алюминия (Al(NO3)3) и хлорид магния (MgCl2).
Образование нитратов магния также возможно при реакции нитратов серы (MgSO4) и марганца (Mg(NO3)2).
Важно отметить, что некоторые нитраты магния могут быть неустойчивыми и разлагаться при нагревании, образуя оксид магния и оксид азота.
Способ получения
Щелочноземельные нитраты
Щелочноземельные нитраты, включая нитрат магния, могут быть получены путем реакции соответствующих гидроксидов, оксидов или гидрокарбонатов с азотной кислотой или аммиачным раствором. При этом образуются соли нитратов магния, кальция и бария.
Реакция разложения нитрата магния
Нитрат магния также может быть получен путем реакции металлов, таких как алюминий, с нитратами. Например, реакция алюминия с нитратом магния приводит к образованию нитрата магния и алюминия:
3Mg(NO3)2 + 2Al → 3Mg + Al(NO3)3
Результатом этой реакции является образование магния и нитрата алюминия.
Другим способом получения нитрата магния является растворение магнезита (карбоната магния) в азотной кислоте:
MgCO3 + 2HNO3 → Mg(NO3)2 + CO2 + H2O
При этом образуется нитрат магния, углекислый газ и вода.
Оба этих способа — реакция алюминия с нитратом магния и растворение магнезита в азотной кислоте — являются химическими способами получения нитрата магния. Они позволяют получить качественную и чистую реакцию с высоким выходом продукта.
Качественная реакция
При взаимодействии нитрата магния с водой проявляются следующие химические свойства:
- Образуются нитраты, оксиды и гидроксиды магния;
- Может образовываться азотная кислота и кислород;
- Могут образовываться нитраты меди, кальция, лития и алюминия;
- Могут образовываться гидрокарбонаты, гидрофосфаты и дигидрофосфаты магния;
- При высокой температуре может происходить разложение нитратов с образованием оксидов.
Реакция разложения нитрата магния водой является хорошим примером качественной реакции, так как при ее проведении можно наблюдать наглядные изменения вещества. В результате разложения нитрата магния водой образуются различные продукты, которые можно увидеть и описать.
Для получения качественной реакции разложения нитрата магния водой можно использовать следующие способы:
- Взять определенное количество нитрата магния и добавить его в воду;
- Постепенно добавлять воду к нитрату магния до полного растворения;
- Наблюдать изменения внешнего вида реагентов и образование новых соединений.
На данном этапе может происходить разложение нитратов магния с образованием нитратов других элементов, а также гидрооксидов и оксидов.
Таким образом, реакция разложения нитрата магния водой является качественной, так как в ходе нее проявляются различные химические свойства веществ, образуются новые соединения, которые можно наблюдать и описать.
Химические свойства
Химические свойства нитратов металлов щелочноземельных групп сходны с свойствами других натрия и кальция. При взаимодействии с водой нитраты щелочноземельных металлов разлагаются с образованием гидроксидов и оксидов металлов, а также нитрата натрия или кальция.
Разложение нитратов щелочноземельных металлов может происходить при нагревании или под действием других веществ. Например, при нагревании нитрата магния Mg(NO3)2 водородный нитрат вступает в реакцию окисления с углем и образует оксид магния.
Некоторые нитраты, такие как нитрат аммония NH4NO3 и нитрат бария Ba(NO3)2, могут разлагаться с образованием нитритов и кислорода. Разложение нитрата меди Cu(NO3)2 может происходить под действием света с образованием нитрита меди и кислорода.
Азотный оксид NO2 может образовываться при разложении нитратов при высокой температуре или в качественной реакции с оксидом карбоната марганца MnCO3. Хлорида меди CuCl2 может образовываться при взаимодействии нитрата лития LiNO3 с хлоратом бария Ba(ClO3)2.
Некоторые нитраты образуют гидрокарбонаты, например, нитрат калия KNO3 при взаимодействии с угольной кислотой H2CO3 образует гидрокарбонат калия KHCO3. Также некоторые нитраты могут образовывать гидрокарбонаты щелочных металлов при реакции с угольной кислотой.
Действие некоторых кислот на нитраты приводит к образованию нитридов. Например, разложение нитрата кальция Ca(NO3)2 под действием серной кислоты H2SO4 приводит к образованию нитрида кальция Ca3N2.
Некоторые нитраты, такие как нитрат марганца Mn(NO3)2, образуются посредством перекисной окислители с участием кислорода и окисления.
Реакции разложения
Разложение оксидов
Многие оксиды металлов под воздействием кислоты разлагаются на оксид и воду. Например, оксид кальция при действии соляной кислоты разлагается по следующей реакции:
CaO + 2HCl → CaCl2 + H2O
Разложение нитратов
Нитраты тяжелых металлов, таких как нитрат серебра или нитрат марганца, могут разлагаться под действием тепла или других реагентов. Например, разложение нитрата меди осуществляется следующей реакцией:
2Cu(NO3)2 → 2CuO + 4NO2 + O2
Разложение нитратов может быть также результатом действия кислот или других веществ. Например, разложение нитрата лития под действием серной кислоты происходит по следующей реакции:
LiNO3 + H2SO4 → Li2SO4 + HNO3
Разложение хлоридов
Хлориды металлов могут подвергаться разложению при взаимодействии с щелочной средой или другими реагентами. Например, разложение хлората бария осуществляется следующей реакцией:
Ba(ClO3)2 → BaCl2 + 3O2
Разложение карбонатов
Карбонаты металлов разлагаются при взаимодействии с кислотами, высокой температуре или другими факторами. Например, разложение карбоната кальция под воздействием соляной кислоты происходит по следующей реакции:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Разложение гидрокарбонатов
Гидрокарбонаты металлов также могут разлагаться при нагревании или действии кислот. Например, разложение гидрокарбоната алюминия происходит по следующей реакции:
2Al(HCO3)3 → Al2O3 + 6CO2 + 3H2O
Разложение нитритов и сульфитов
Нитриты и сульфиты могут разлагаться под воздействием кислот или других реагентов. Например, разложение нитрита натрия осуществляется следующей реакцией:
2NaNO2 → 2NaNO3 + O2
А разложение сульфита аммония происходит по следующей реакции:
(NH4)2SO3 → 2NH3 + H2O + SO2
Таким образом, реакции разложения являются важным аспектом химии, позволяющим получить различные вещества и исследовать их свойства.
| Вещество | Результат разложения |
|---|---|
| Нитраты | Образование оксидов и диоксида азота |
| Хлориды | Образование хлора и основы |
| Карбонаты | Образование оксида металла и выделение углекислого газа |
| Гидрокарбонаты | Образование оксида металла и выделение углекислого газа |
Разложение оксидов
Например, некоторые оксиды могут разложиться при нагревании или взаимодействии с водой. При нагревании некоторых оксидов металлов образуется соответствующий хлорид. Разложение оксида меди (II) происходит при нагревании до высоких температур, и образуется качественная соль хлорида меди (II).
Оксиды, такие как нитрат натрия, могут разлагаться при нагревании или взаимодействии с другими веществами. Разложение нитрата натрия происходит при нагревании, образуя нитрит натрия, кислород и оксид натрия. Такие реакции могут осуществляться как при обычной температуре, так и при повышенных температурах.
Некоторые оксиды образуются в результате химического взаимодействия других веществ. Например, оксид азота (II) образуется при взаимодействии аммиака и хлора, при этом также образуется нитрат аммония. Оксиды могут также образовываться при взаимодействии металлов с кислотами. Например, марганец разлагается под действием соляной кислоты, образуя нитрат марганца (II) и медленно выделяющийся хлор.
Существуют различные способы разложения оксидов в зависимости от конкретного соединения и условий реакции. Некоторые оксиды, такие как перманганат калия, разлагаются под действием света. Другие оксиды могут разлагаться при взаимодействии с другими веществами, например, соляной кислотой или гидроксидом натрия.
Некоторые оксиды довольно неустойчивы и могут распадаться или разлагаться при нагревании до определенной температуры. Например, нитрат бария распадается при нагревании до оксида бария и кислорода. Оксиды тяжелых металлов, такие как оксид серебра, разлагаются при нагревании до высоких температур.
| Оксид | Разложение |
|---|---|
| Оксид лития | Разлагается при нагревании до оксида и кислорода |
| Оксид меди (II) | Разлагается при нагревании до хлорида и кислорода |
| Оксид бария | Распадается при нагревании до оксида и кислорода |
Качественная реакция на разложение оксида может быть использована для определения наличия или отсутствия соответствующего соединения. Например, оксид меди (II) можно обнаружить, добавив к нему раствор аммиака, так как при этом образуется синее соединение.
Разложение оксидов может иметь место и при взаимодействии с другими химическими веществами. Например, оксид меди (II) может разлагаться при контакте с соляной кислотой, образуя нитрат меди (II) и выделяющийся хлор. Оксиды также могут разлагаться под воздействием света или высоких температур.
Способы разложения оксидов:
- Разложение оксида при нагревании до определенной температуры
- Разложение оксида под действием других химических веществ, например, кислоты или основания
- Разложение оксида под воздействием света
Информация о разложении оксидов может быть полезна при изучении химических реакций и свойств различных соединений.
Разложение гидроксидов
Если гидроксид нагреть, то он может разложиться с образованием оксида металла и воды. Например, гидроксид бария (Ba(OH)2) при нагревании распадается на оксид бария (BaO) и воду:
| Исходное соединение | Результат разложения |
|---|---|
| Ba(OH)2 | BaO + H2O |
Кроме того, гидроксиды могут разлагаться под воздействием кислоты. Например, гидроксид калия (KOH) при взаимодействии с соляной кислотой (HCl) превращается в хлорид калия (KCl) и воду:
| Исходное соединение | Результат разложения |
|---|---|
| KOH + HCl | KCl + H2O |
Также некоторые гидроксиды неустойчивы к действию света и могут разлагаться. Например, гидроксид магния (Mg(OH)2) под действием света разлагается на оксид магния (MgO) и воду:
| Исходное соединение | Результат разложения |
|---|---|
| Mg(OH)2 | MgO + H2O |
Таким образом, разложение гидроксидов – это химические реакции, при которых гидроксиды превращаются в другие соединения, такие как кислоты, оксиды или нитраты. Разложение может происходить под воздействием разных факторов, включая температуру, кислоту и свет. Как правило, реакции разложения гидроксидов являются качественной реакцией, то есть они позволяют получить новые соединения или распознать исходные гидроксиды.
Разложение кислот
Разложение нитратов
Нитраты — это соли азотной кислоты. При разложении нитратов образуются оксиды и нитриты. Например, нитрат магния (Mg(NO3)2) при разложении водой образует нитрит магния (Mg(NO2)2) и оксид магния (MgO).
Разложение карбонатов
Карбонаты — это соли угольной кислоты. При разложении карбонатов образуются оксиды и углекислый газ (CO2). Например, карбонат магния (MgCO3) при разложении с помощью кислоты образует оксид магния (MgO) и углекислый газ (CO2).
Разложение хлоратов
Хлораты — это соли хлорной кислоты. При разложении хлоратов образуются хлориды и кислород. Например, хлорат калия (KClO3) при нагревании разлагается на хлорид калия (KCl) и кислород (O2).
Разложение перхлоратов
Перхлораты — это соли перхлорной кислоты. При разложении перхлоратов образуются хлориды и кислород. Например, перхлорат бария (Ba(ClO4)2) при нагревании разлагается на хлорид бария (BaCl2) и кислород (O2).
| Кислота | Образующиеся продукты разложения |
|---|---|
| Нитраты | Нитриты и оксиды металлов |
| Карбонаты | Оксиды металлов и углекислый газ |
| Хлораты | Хлориды и кислород |
| Перхлораты | Хлориды и кислород |
Также существуют и другие способы получения кислот и их солей, например, взаимодействие кислот с основаниями или оксидами металлов. Разложение кислот играет важную роль в химических реакциях, так как позволяет получить нужные продукты или освободить необходимые химические вещества.
Разложение солей
Разложение нитратов
Нитраты, например нитрат магния, могут разлагаться при нагревании. При этом образуются гидроксид магния и оксид азота. Иногда, при разложении нитратов при наличии органических веществ, может образоваться и сера.
Разложение хлоратов
Хлораты, например хлорат бария, при нагревании разлагаются с образованием гидроксида бария и хлорида бария. Реакция разложения хлоратов является довольно опасной и может протекать при возникновении искры или воздействии света.
Разложение солей является важным способом получения элементов или кислоты. Например, при разложении нитратов получаются оксиды, гидрокарбонаты или нитриты, в зависимости от условий реакции. Разложение хлоратов может быть использовано для получения хлорида или карбоната.
Качественная реакция разложения солей может быть использована для определения их состава. Например, при разложении сульфитов, под действием кислоты или гидрофосфатов, образуется оксид серы и вода. Также разложение солей может происходить при воздействии медной проволоки на нитрат серебра или при действии аммония на нитрат меди.
Разложение хлоридов
Хлориды могут разлагаться при воздействии на них различных химических веществ или при повышенной температуре. В результате распада хлоридов образуются различные соединения, такие как гидроксиды, оксиды, нитраты и другие.
Разложение хлоридов с образованием гидроксидов
Если хлорид взаимодействует с щелочной солью или гидроксидом, то может образоваться соответствующий гидроксид металла. Например, хлорид меди при взаимодействии с гидроксидом натрия даёт гидроксид меди и хлорид натрия:
2CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
Разложение хлоридов при нагревании
Некоторые хлориды разлагаются при нагревании, образуя соединения, содержащие кислород (например, оксиды и нитраты) или другие химические соединения. Например, хлорид аммония при нагревании распадается с образованием аммиака и хлорида меди:
2NH4Cl → 2NH3 + H2O + 2HCl
Описанные выше реакции являются лишь некоторыми способами разложения хлоридов. В зависимости от условий и реагентов могут образовываться различные продукты разложения, такие как нитраты, фосфаты, перхлораты и другие.
Информация о свойствах и способах получения различных хлоридов, а также описания и реакции разложения можно найти в химической литературе или на специализированных ресурсах.
Разложение нитратов
Разложение нитратов при действии температуры
При нагревании многие нитраты проводят эндотермическую реакцию разложения с образованием оксида и кислорода. Например, нитрат магния (Mg(NO3)2) разлагается при нагревании до высоких температур с образованием оксида магния (MgO) и выделением кислорода (O2).
Разложение нитратов при действии кислоты
Некоторые нитраты могут разлагаться под воздействием кислоты. Например, нитрат меди (Cu(NO3)2) при взаимодействии с кислородной кислотой (H2SO4) разлагается на основной оксид меди (CuO), кислород и азотные оксиды.
Разложение нитратов при действии света
Некоторые нитраты могут разлагаться под воздействием света. Например, нитрат серебра (AgNO3) разлагается при освещении светом, образуя серебро (Ag), оксид и кислород.
Разложение нитратов при действии других веществ
Нитраты могут разлагаться при действии щелочноземельных металлов, карбонатов, кислот и других соединений. Например, нитрат бария (Ba(NO3)2) разлагается при взаимодействии с гидроксидом бария (Ba(OH)2) с образованием оксида бария (BaO) и нитратной кислоты (HNO3).
| Реактивы | Продукты разложения |
|---|---|
| Нитрат аммония (NH4NO3) | Оксид азота (NO), оксид и вода |
| Нитрат кальция (Ca(NO3)2) | Оксид кальция (CaO), оксид и кислород |
| Нитрат натрия (NaNO3) | Оксид натрия (Na2O), оксид и кислород |
| Нитрат магния (Mg(NO3)2) | Оксид магния (MgO), оксид и кислород |
Информация о разложении нитратов полезна для понимания химических реакций и процессов в химической промышленности. Она также может быть использована для получения определенных продуктов разложения, например, в процессе получения гидроксидов, оксидов или других соединений.
Видео:
Разложение нитратов
Разложение нитратов by easy chem 2,385 views 4 years ago 1 minute, 49 seconds