- Химическое уравнение реакции серной кислоты с водой
- Серная кислота – химические свойства и промышленное производство
- Промышленное производство серной кислоты контактный способ
- Этапы реакции:
- Химические свойства серной кислоты
- Особые свойства концентрированной H2SO4
- Серная кислота
- Серная кислота
- Видео:
- Серная кислота. Химические свойства. Реакции с металлами.
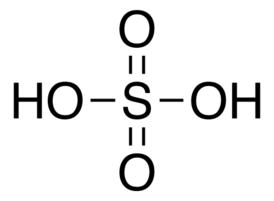
Химическое уравнение реакции серной кислоты с водой
Реакция серной кислоты с водой, о которой идет речь в данной статье, является одной из наиболее известных и широко используемых химических реакций. При комнатной температуре серная кислота представляет собой бесцветную летучую жидкость с характерным запахом, которая обладает большим количеством химических свойств и применяется во многих отраслях промышленности.
Взаимодействие концентрированной серной кислоты с водой – обратимая реакция, происходящая с высвобождением большого количества тепла. Поэтому при проведении данной реакции необходимо соблюдать определенные условия и предосторожности.
Реакция серной кислоты с водой является особенной: кислота обладает сильными окислительными свойствами, а вода – свойствами восстанавливаться. Такое взаимодействие возможно благодаря большой активности серной кислоты. При комнатной температуре она протекает весьма медленно, однако при нагревании, под действием дополнительного источника тепла или в
контактном сопряжении с определенными веществами, реакция идет намного быстрее.
Серная кислота – химические свойства и промышленное производство
H2O + SO2 → H2SO4
Как видно из реакции, серная кислота образуется путем окисления сернистого оксида SO2 водой. Процесс этой реакции происходит при высокой температуре и сильным присутствием промежуточного вещества в виде олеума H2S2O7.
Серная кислота обладает рядом особых свойств. Она сильно растворяется в воде и образует вязкую жидкость с высокой кислотностью. Серная кислота также образует соли, которые называются сульфатами. Одним из важных применений серной кислоты является её использование в качестве катализатора при производстве различных химических веществ.
Промышленное производство серной кислоты осуществляется в несколько этапов. На первом этапе сера сжигается в специальной печи при оптимальных температурах и с контролируемой концентрацией кислорода. В результате этого процесса образуется серный оксид, который затем взаимодействует с водой в присутствии олеума.
Олеум получается путем смешивания серной кислоты с серной оксидом. Этот процесс особенно важен для влажного и сильно загрязненного газа, так как олеум способен выполнять очистку от примесей более эффективно. Далее, второй этап производства серной кислоты включает обработку олеума с добавлением влажного воздуха.
При этом происходит контактный процесс, в ходе которого серный оксид, содержащийся в олеуме, окисляется кислородом из воздуха и превращается в серную кислоту. После этого серную кислоту можно дополнительно очистить и получить концентрированную продукцию.
Применение серной кислоты в промышленности обширно. Она используется для производства основных солей серы, а также при получении кислоты ванадия, металлических солей, циклонов и других важных соединений. Кроме того, серная кислота играет важную роль в процессе очистки металлов и образовании оксидов серы.
Промышленное производство серной кислоты контактный способ
В процессе производства используется взаимодействие между серной кислотой и водородом при высокой температуре (>400°C) на специальной установке. Катализатором является оксид хрома(III) или металлическая поверхность. Реакция протекает по следующей схеме:
Этапы реакции:
- Вода и серная кислота в холодной концентрированной форме связываются через химическое взаимодействие, образуя пирита-пирит (FeS2).
- Взаимодействие с водой происходит в двух этапах: получение пирита и его окисление до серы на воздухе.
- Образовавшаяся сера растворяется в серной кислоте, образуя частично нейтрализованную водой серную кислоту, олеум (H2SO4нSO3).
- Далее происходит очистка олеума от пирита и противотока с водой, насытить водяна кислота разбавленными растворами солями.
- Смесь атомов серы и кислоты образуют концентрированную серную кислоту.
Особенность контактного способа в производстве серной кислоты заключается в том, что реакция протекает на поверхности катализатора, а катализатор сам не участвует в химической реакции.
На выходе получается концентрированная серная кислота, которая имеет множество применений в различных отраслях промышленности. Она служит основой для производства удобрений, пластмасс, аккумуляторов, железнодорожных шпал, красителей и многих других продуктов.
Химические свойства серной кислоты
Серная кислота концентрированная обладает свойствами сильного окислителя. При взаимодействии с окисляемыми веществами происходит процесс окисления, при котором серная кислота сама восстанавливается. Кислота реагирует с многими металлами, образуя соли – сульфаты. Данная реакция происходит через стадию образования сернистого (H2SO3) и серного (H2SO2) оксидов, которые растворяются в кислоте.
Концентрированная серная кислота является мощным диссоциантом, то есть способна диссоциировать воду и образовывать большое количество ионов водорода (H+) и сульфатных ионов (SO42-).
Процесс образования кислотных растворов средней концентрации происходит при плавлении серного оксида (SO3) с водой. При этом происходит следующая химическая реакция:
| SO3 + H2O | <-> | H2SO4 |
Серная кислота вступает в реакцию как окислитель, способный окислять многие вещества. Под действием серной кислоты происходит окисление соединений ванадия, образуя различные оксиды ванадия, а также происходит окисление хлорида натрия до хлора. При этом сама серная кислота восстанавливается.
Концентрированная серная кислота является отличным окислителем и используется в промышленности для очистки газов от примесей. Обычно для этой цели используется печь с катализатором, где газовая смесь пропускается через концентрированную серную кислоту и происходит окисление различных оксидов металлов до их сульфатных солей.
Разбавленная серная кислота, также известная как серный элеватор, подходит для обменных процессов и процессов очистки. При этом она не является сильным окислителем, но обладает достаточной активностью для восстановления различных неорганических оксидов и слабо-окисляющей способностью на прямой стадии.
Концентрированная серная кислота находит свое применение в процессе получения концентрированного серного оксида путем кипячения обычного кислотного раствора. Конечным продуктом этапа окисления является оксид серного, который потом используется в производстве сульфата или в других промышленных целях.
Температура концентрированной серной кислоты может достигать 338 градусов Цельсия. При этой температуре происходит дезгидратация кислоты, т.е. отделение воды.
Серная кислота также широко используется в процессе очистки, ванадия в прокатных печах, для создания аккумуляторов, в качестве катализатора и в других промышленных процессах.
Таким образом, химические свойства серной кислоты делают ее весьма полезным и универсальным веществом для различных областей применения.
Особые свойства концентрированной H2SO4
Одним из особых свойств концентрированной H2SO4 является ее способность окислять многие вещества. Благодаря своей силе кислоты, она может воздействовать на различные оксиды металлов, превращая их в соответствующие соли. Кроме того, H2SO4 может окислять не только металлы, но и некоторые нелетучие органические вещества, такие как алканы и алкены.
Концентрированная серная кислота также является поглотителем влаги. Она может быстро абсорбировать воду из окружающей среды, образуя дымку на воздухе. В результате этого реакции кислота разбавляется и поглощает влагу, что делает ее более безопасной для использования.
H2SO4 может также проявлять амфотерные свойства, что означает, что она может реагировать и с кислотными, и с щелочными веществами. Например, она может реагировать со щелочами, такими как NaOH, образуя соль натрия (Na2SO4) и воду. Или она может взаимодействовать с кислотами, такими как HCl, образуя соль хлорида железа (FeCl3).
Концентрированная H2SO4 также является каталитическим агентом в реакциях окисления. Например, она может служить катализатором при окислении серы в серный оксид (SO2) или при окислении ванадия в ванадийной кислоте.
Серную кислоту также часто используют в промышленности для очистки различных веществ от примесей металлов. Олеум — смесь концентрированной серной кислоты и SO3 — исполняет роль средства для получения высоких концентраций кислоты и паров SO3 без необходимости использования кипящей воды в процессе. Кроме того, концентрированная H2SO4 широко применяется в производстве солей, серы, железа и других продуктов.
Серная кислота
Взаимодействие серной кислоты с водой осуществляется по принципу амфотерных свойств. При этом образуется серные кислоты, а также сернистого оксид. Реакция происходит при оптимальных температурах и концентрации веществ.
Серная кислота образуется во втором этапе процесса очистки газа серной кислотой. Затем она используется в качестве катализатора при взаимодействии с серными парами в специальной печи. Также серная кислота активно взаимодействует с различными металлами, в результате чего образуются соли серной кислоты.
Серная кислота имеет широкое применение в промышленности. Она используется для производства серной кислоты, а также для образования серных противотока. Благодаря своим свойствам, серная кислота находит применение в различных отраслях промышленности, таких как производство удобрений, очистка воды и др.
Кроме того, серная кислота является основным компонентом в реакции серной кислоты с водой, при которой образуется серная кислота и сернистый оксид. Эта реакция происходит при концентрированной серной кислоте и в качестве катализатора выступает ванадий.
Серная кислота также может взаимодействовать с металлами, например, железом, пиритом и хлоридом натрия, при этом образуются различные соли серной кислоты.
Серная кислота обладает высокими коррозионными свойствами и может вызывать ожоги при контакте с кожей. Поэтому необходимо быть очень осторожным при работе с ней.
Серная кислота
При взаимодействии с водой происходит реакция, в результате которой образуется концентрированная серная кислота и поглотительной свойство сернистого кислоты. Реакция серной кислоты с водой является примером амфотерной реакции, так как серная кислота выступает в роли кислоты, а вода — в роли основания.
Концентрированная серная кислота (H2SO4) обладает высокой активностью в химических реакциях и может взаимодействовать с различными веществами. В присутствии серной кислоты концентрированная сера образует серную кислоту или летучую серную кислоту (олеум).
Серная кислота также реагирует с металлами, образуя соли серной кислоты. В этапе реакции оксиды взаимодействуют с концентрированной серной кислотой, образуя сульфаты металлов.
Серная кислота обладает способностью очищать газы от примесей. В промышленности концентрированная серная кислота используется в контактном процессе для очистки газов при производстве силы и печей, а также в башнях обменных кислот и газов.
Разбавленная серная кислота (H2SO4) обладает различными свойствами. Например, при взаимодействии с солями серная кислота образует соль серной кислоты. Также способна выделять ванадия из его хлорида при нагревании.
Серная кислота в кипящем состоянии с водородом окисляется и образует серу и разбавленную серную кислоту.
Серная кислота обладает множеством свойств и может использоваться в различных химических реакциях и промышленных процессах.
Видео:
Серная кислота. Химические свойства. Реакции с металлами.
Серная кислота. Химические свойства. Реакции с металлами. by День знаний 76,900 views 8 years ago 10 minutes, 55 seconds