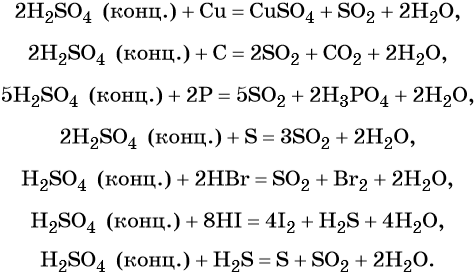Химическая реакция нагревания серы водой: что происходит и как это влияет на окружающую среду
Сера (S) – один из самых распространенных элементов, встречающийся в природе в земной коре, а также в виде серных минералов, каких только не существует. Сера образует целую группу различных соединений, в которых валентными являются атомы серы. Моноклинная серная кислота (H2S) является одним из самых основных соединений серы.
Самой часто встречающейся реакцией серы является ее простое окисление в водной среде. При этом в присутствии кислорода образуются сульфиты, которые в лабораторных условиях процесс получения называют реакцией соли. Сульфиты имеют плотность, что делает их сильными растворителями обманка.
В воде сера окисляется веществами, которые обладают окислительными свойствами, такими как сернисто-кислотный раствор, валентных тетраоксидом или сероводородом. Реакции, в которых участвуют соединения серы, являются одними из самых резких и химически активных реакций с неметаллами.
Применение серы широко встречается в самых различных отраслях промышленности и техники. Медицина, например, применяет серу как препарат в виде сульфитов и сульфатов в химической лаборатории. Реакция между серной кислотой и основными оксидами или гидроксидами называется основной реакцией серы.
Сера – химические свойства получение соединения VIа группа
Сера встречается в природе в виде сернистых соединений, таких как сернистый газ (SO2) и сернистая кислота (H2SO3). Она также часто используется в промышленном производстве в качестве сырья для получения различных соединений серы.
Сера образует многочисленные химические реакции, особенно взаимодействуя с кислородом и р-элементами. При взаимодействии с кислородом она образует сернистый газ (SO2) и серу оксиды. Взаимодействие с р-элементами, такими как барий (Ba), приводит к образованию сульфидов и сульфатов.
Кроме того, сера может реагировать с водой при нагревании, образуя сероводород (H2S) и серную кислоту (H2SO4). При этом может образовываться большое количество сернистого газа, который обладает резким запахом и темно-желтой окраской.
Сера имеет восстановительные свойства и может выступать как окислитель. Она способна образовывать соединения с различными элементами, включая металлы и неметаллы. Например, она может образовывать сульфиды с некоторыми металлами, такими как свинец (Pb) или железо (Fe), и сульфаты с некоторыми неметаллами, как кислород (O) или фосфор (P).
Сера также играет важную роль в биологических системах, где она может входить в состав различных биологических соединений, таких как аминокислоты и витамины. Она также является ключевым компонентом в коронах и барит.
Получение серы может происходить как из природных открытых источников, так и с использованием специальных технологий. Одним из основных способов получения серы является восстановление серной кислоты с помощью простого окислителя. Например, серу можно получить, взаимодействуя серную кислоту с металлами или оксидами.
Сера является важным веществом в химической промышленности и энергетическом секторе. Она широко используется в производстве сульфитов, сульфатов и других соединений серы.
Нахождение серы в природе
Сера также может быть найдена в газообразной форме. Это может быть свободная сера, которая образуется при реакции серы с кислородом или водяными паровыми системами. Например, при нагревании серы с водой может образовываться сероводород (H₂S) газ, который имеет характерный запах гнилых яиц.
Присутствие серы в природе имеет большое значение. Сера используется в промышленном производстве для получения различных соединений и продуктов, таких как серные кислоты и серные оксиды. Также сера имеет применение в лабораторных исследованиях, где она может быть использована в реакциях и аналитических методах.
Кроме того, сера используется в производстве цинковой короны для получения сульфидов. Сера также является валентным элементом в различных органических соединениях. Это объясняется способностью серы образовывать молекулы с разнообразными свойствами в присутствии кислот и оксидов.
В природе существуют две главные формы серы: α-сера и β-сера. Альфа-сера обычно является стабильной формой, в то время как бета-сера диссоциирует, образуя моноклинную серу. Данное свойство играет важную роль в различных химических реакциях и процессах.
В целом, сера является неотъемлемой частью земной коры и встречается в различных формах и соединениях. Она имеет значительное химическое и промышленное применение, а также является важным элементом в различных биохимических процессах.
Аллотропные модификации серы
В природе сера существует в различных аллотропных модификациях, каждая из которых обладает своими уникальными свойствами и применением.
Одним из наиболее распространенных и известных аллотропных модификаций серы является α-сера. Она представляет собой стабильную модификацию серы при нормальных условиях и является самородной серой. α-Сера обладает свойствами пластической массы, способной к тонкому расплавлению и формированию различных изделий из серы.
Более редкой, но также встречающейся модификацией серы является β-сера. Она образуется при плавлении α-серы и характеризуется темно-желтыми молекулами и более высокой плотностью.
Реакция серы с водой при нагревании приводит к образованию сероводорода (H2S) – важного соединения серы. Сероводород – кислота, которая образуется в результате взаимодействия серы с водой при нагревании. Она имеет ряд применений в различных сферах, включая медицину и энергетическую промышленность.
Еще одной модификацией серы является сернистый газ (SO2). Он образуется при сгорании серы и применяется в качестве окислителя, а также используется в производстве кислоты серной и соединений серы.
Соль оксидами серы, такие как сульфиты, широко используются в различных соединениях и при получении соединений серы, включая сульфаты и пириты. Например, цинковая соль сернистой кислоты (ZnSO3) может быть получена в результате реакции оксида цинка с серным газом.
Таким образом, сера обладает разнообразными аллотропными модификациями и имеет широкое применение в различных областях, включая промышленность, энергетику и медицину.
Видео:
Реакция соединения серы с железом
Реакция соединения серы с железом by Ретро Ностальгия 1,964 views 3 years ago 1 minute, 29 seconds