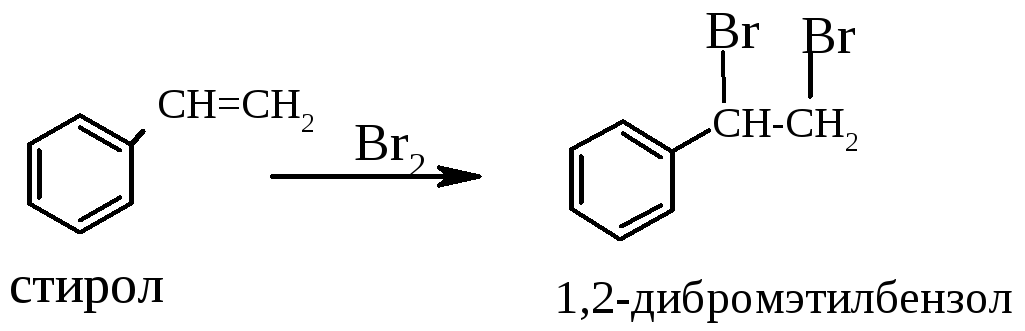
- Взаимодействие стирола с бромной водой: химические реакции и возможные применения
- Химические свойства аренов
- Химические свойства аренов
- 1 Реакции присоединения
- 11 Гидрирование
- 12 Хлорирование аренов
- 2 Реакции замещения
- 21 Галогенирование
- 22 Нитрование
- 23 Алкилирование ароматических углеводородов
- 24 Сульфирование ароматических углеводородов
- 3 Окисление аренов
- 31 Полное окисление – горение
- 32 О кисление гомологов бензола
- Видео:
- Получение Брома. Красивые опыты.
Взаимодействие стирола с бромной водой: химические реакции и возможные применения
Стирол — это газообразное органическое соединение, представляющее собой одну из форм стирена — вещества, в котором замещен один атом водорода метильной группой (CH3). Взаимодействуя с бромной водой, стирол и бром вступают в реакцию, образуя бромистый мета-хлортолуол.
Строение стирола позволяет ему активно взаимодействовать с ароматическими углеводородами, такими как бензол. В процессе хлорирования или галогенирования этих соединений, в присутствии катализаторов, окисления или кисления, стирол преимущественно присоединяет галогены к кольцу бензола, образуя соответствующие заместители арены.
Алкилирование также является характерной реакцией стирола. В присутствии кислоты и катализатора, углеводородные цепи присоединяются к мета-положению атома углерода в кольце стирола, образуя мета-алкилстирол. Карбонат железа (FeBr3) может использоваться в качестве катализатора при окислении стирола в присутствии углекислого газа (CO2) для получения стирола с высокой концентрацией.
Стирол также может окисляться до формирования стирола оксид и других продуктов при воздействии света или кислоты. При горении стирола образуются оксиды углерода и водяной пар. Нитро-группа, добавленная к бензолу путем нитрирования, приводит к образованию этилбензола. В присутствии хлора и карбоната железа, стирол образует зольную соль, состоящую только из продуктов хлорирования.
Химические свойства аренов
Арены могут образовываться в результате химических реакций. Например, при нагревании толуола (метилбензола) или стирола (алкилированного бензола) образуется вторая связь в кольце.
Галогенирование аренов протекает в присутствии галогенов, таких как хлор или бром. В результате образуются галоген-заместители аренов.
Кислотное охождение происходит при воздействии кислоты на арены, образуя соответствующий измененный дохор пенумий ор дилины аренист. Мнедо охождение моеть протекать кольце во второго так уже образуется простень на бензольнайн>-торе этилов
- Ароматические углеводороды могут быть хлорированы в присутствии хлора и уксусной кислоты. В результате глав на моноплавле образуются галогенозаместители аренов, такие как хлорбензол.
- Перманганаты обладают окислительными свойствами и могут окислять арены до карбонатов или кислот. Например, бензол может быть окислен до бензойной кислоты.
- Гидрирование аренов может происходить в присутствии катализаторов. В результате образуются алифатические углеводороды. Например, бензол может быть гидрирован до циклогексана.
Горение аренов протекает при сильном нагревании в присутствии кислорода. Продуктами горения являются углеродный диоксид и вода.
В связи с этими химическими свойствами арены находят широкое применение в различных отраслях промышленности. Например, стирол используется в производстве пластмасс и синтетических каучуков.
Химические свойства аренов
Структура аренов, таких как стирол, мета-хлортолуол и другие, обладает особенностями, связанными с ароматической системой атомов углерода. Эти соединения образуют замкнутую цепь из атомов углерода сильными связями. Благодаря этому арены обладают высокой устойчивостью и реакционной активностью.
Одним из общих свойств аренов является их способность к замещению атомов в структуре. Например, при хлорировании заместителями могут быть атомы хлора, а при галогенировании — атомы галогенов (например, хлора).
При действии нейтральной хлорной воды на ареновые соединения происходит замещение атомов водорода атомами хлора. Это явление называется хлорированием и позволяет получать хлорированные углеводороды.
Полное хлорирование арены приводит к образованию хлорбензола, в котором все атомы водорода замещены атомами хлора.
Как и другие арены, стирол и его аналоги могут подвергаться окислению при взаимодействии с окислителями, такими как азотная кислота. В результате такого окисления могут образовываться нитро-группы в молекуле арены.
Арены обладают также возможностью присоединения других функциональных групп. Например, при действии сульфофила на стирол формируется сульфофенильная группа.
Взаимодействие стирола с бромной водой приводит к образованию бромстиролов. Это реакция замещения атомов водорода в молекуле стирола атомами брома.
Свойства аренов также определяются их способностью к гидрированию и горению. При гидрировании арены, например, с помощью катализатора FeBr3, атомы водорода присоединяются к ароматической системе, что приводит к образованию соответствующих циклогексановых соединений.
При горении аренов образуются продукты сгорания, такие как углекислый газ и вода, а качество горения зависит от особенностей заместителей в молекуле арены.
Таким образом, химические свойства аренов определяются взаимодействием атомов углерода, замещенных функциональными группами, и природой этих заместителей.
1 Реакции присоединения
Реакции присоединения стирола, аренов и других бензольных соединений происходят при взаимодействии с различными заместителями. Особенности данных реакций определяются условиями, в которых они протекают.
Кислотное кисление стирола приводит к присоединению углекислого газа и образованию карбоната стирола. При этом образуется перманганат бензильного аниона, который в дальнейшем может быть окислен до мета-хлортолуола. Полное окисление бромида стирола преимущественно происходит с помощью серной кислоты, что приводит к образованию гомологов бензольной серной кислоты.
Нитрование стирола приводит к образованию нитро-группы в боковом кольце стирола. Если стирол содержит непредельные заместители, такие как хлор, то полимеризация протекает сильными кислотами, например, серной кислотой.
Присоединение галогенов к стиролу происходит при нагревании в присутствии хлора или брома. При этом образуется соответствующий галогенистый заместитель. Сульфирование стирола приводит к образованию сульфокислоты соответствующего заместителя.
Общая формула реакций присоединения бензольных соединений включает присоединение группы (перехват, замещение) к бензольному кольцу в результате образования новой связи между ними. Эти реакции часто протекают под воздействием света или при повышенном давлении и температуре.
11 Гидрирование
Гидрирование представляет собой реакцию присоединения водорода к ароматическим соединениям в присутствии катализаторов и при повышенном давлении. В результате гидрирования происходит присоединение водорода к двум соседним атомам углерода в ароматическом кольце, что приводит к насыщению соединения и образованию насыщенных углеводородов.
При гидрировании стирола, например, в качестве катализатора может использоваться металлическое железо. При действии высокого давления и температуры, а также в присутствии катализатора, ароматическое кольцо стирола образуется бензолное кольцо циклогексана.
Гидрирование происходит в два этапа. Сначала металлическое железо образует комплекс с двумерным стиролом, затем молекула водорода присоединяется к стиролу, образуя циклогексен.
| Условия реакции гидрирования стирола: | Рекакции гидрирования стирола: |
| Температура: высокая Давление: высокое Катализатор: железо | C6H5CH=CH2 + H2 → C6H11CH3 |
Гидрирование стирола является одной из важных реакций в органической химии и применяется в промышленности для получения различных углеводородов с использованием технических жирных кислот. Реакция гидрирования также может протекать в присутствии сильных электрофильных заместителей.
12 Хлорирование аренов
Степень хлорирования ароматических соединений зависит от условий проведения реакции. В присутствии кислоты или перманганата калия ароматические соединения частично обесцвечиваются, так как они взаимодействуют с кислотой или окислителем. Такое воздействие обусловлено тем, что под действием кислоты и перманганата калия ароматическая связь от окисления переходит в карбонильную группу (-С=О).
В процессе хлорирования аренов активируется ароматическое кольцо благодаря воздействию бромной воды и кислоты. Перманганат калия используется для усиления окисления веществ. При окислении полимеризации стирола образуются двuvзаимосвязывающикся цепи, содержащие атомы хлора. Это общая формула стирола: 245--С6Н5-СН2-СН=СН2
Хлорирование толуола проходит в условиях сульфирования или полного окисления вещества. При сульфировании образуются мета- и орто-хлортолуол, а при полном окислении получается бензойная кислота.
Окисление аренов – это реакция, в которой в молекуле ароматического соединения происходит замещение атомов водорода атомами кислорода. В результате образуются гидроксильные или оксогруппы, а также азотные и нитро-группы.
Хлорирование ароматических соединений в зависимости от условий проведения реакции может протекать различными путями. Например, под действием сильных окислителей может происходить замещение атомов водорода атомами хлора.
В процессе хлорирования ароматических соединений образуется хлорированный бензол, который является газом при нормальной температуре и давлении. Итого, в результате хлорирования ароматических соединений образуется полное кольцо хлорированных заместителей.
2 Реакции замещения
Одной из самых известных реакций замещения для стирола является гидрирование, при котором двойная связь в кольце стирола преимущественно окисляется и стирол превращается в полноценный алифатический углеводород (этилбензол, например). Эта реакция протекает при высокой температуре и давлении, в присутствии катализатора, обычно металлов или их соединений.
Другой важной реакцией замещения для стирола является галогенирование. Под действием хлором или бромом атомы водорода в молекуле стирола замещаются галогенными атомами. Эта реакция может протекать на свету или при нагревании в присутствии галогенов, например, в бромной воде. Результатом такой реакции может быть образование галоген-стироловой соли.
Также стирол может подвергаться реакциям алкилирования и ацилирования, в результате которых в молекуле стирола замещаются атомы водорода на другие заместители, содержащие алкильные или ацильные группы. Эти реакции проходят в нейтральной среде при нагревании сильных кислот или при взаимодействии стирола с соответствующими заместителями.
Таким образом, стирол благодаря своим свойствам ароматических углеводородов может участвовать в различных реакциях замещения, что делает его полезным сырьем для получения различных полимеров и промежуточных продуктов химической промышленности.
21 Галогенирование
2-галогенирование бензола – это замещение двух атомов водорода хлором, бромом или йодом в молекуле бензола. Например, при галогенировании бромом образуется бромбензол. При галогенировании происходит разрыв ароматической связи и присоединение галогена к углеводородному остову.
3-галогенирование бензола может происходить при действии нейтральной или хлорированной бромной воды. В результате образуются соответствующие 3-галогенированные продукты, например, 3-бромбензол.
4-галогенирование бензола происходит при воздействии газа брома на непредельные углеводороды, такие как стирол. В этом случае происходит присоединение брома к полиэнеу, что приводит к образованию полибромистиленов.
Галогенирование ароматических соединений может также происходить при действии галогенов в виде своих халогенидов, например, хлорида железа (III), бромида железа (III) или фторида железа (III). В этом случае образуются галогенированные соединения, которые могут использоваться в качестве сырья для получения полимеров и других продуктов.
22 Нитрование
Нитрование является одной из важных реакций, которая преимущественно протекает в ароматическом кольце стирола. В результате нитрования в молекуле стирола в альфа-положении кольца присоединяется нитро-группа (-NO2). Нитрование проводят в условиях нагревания сильных нитрирующих смесей, например фебриля (FeBr3) и соляной азотной кислоты (HNO3). Стоит отметить, что нитрование не протекает без использования каталитических добавок, таких как FeBr3.
Нитрирование бензола позволяет получить нитробензол. Нитрование стирола приводит к образованию 4-нитростирола. В результате нитрования стирола получается соль, которая содержит нитро-группу и имеет формулу C8H7NO2.
Нитрирование является важной реакцией, т.к. позволяет внести в молекулу ароматических углеводородов заместитель в виде нитрогруппы, что изменяет их физические и химические свойства. Нитробензол, например, обладает более высокой плотностью, чем бензол, а также обладает свойствами нитроаренов, такими как образование плавкого и взрывоопасного тротила.
Также, стирол может быть подвергнут галогенированию, например бромированию. В результате бромирования стирола, в молекуле образуется бромида, которое может быть использовано в дальнейших реакциях. Бромирование преимущественно протекает в нейтральной среде, при наличии катализаторов, таких как FeBr3. Бромирование стирола приводит к получению бромстирола.
Таким образом, нитрование и бромирование являются важными реакциями, которые позволяют внести в молекулу стирола различные функциональные группы, изменяющие его свойства. Эти реакции широко применяются в органическом синтезе для получения различных продуктов и соединений.
23 Алкилирование ароматических углеводородов
Алкилирование стирола может происходить в присутствии кислоты Фриделя-Крафтса (FeBr3), что позволяет получить алкилстиролы. Формула стирола представляет собой бензольное кольцо с присоединенной к нему двойной связью и метиловой группой. Алкилирование стирола позволяет получить структурные гомологи, такие как этилбензол и мета-хлортолуол.
Алкилирование аренов может быть ориентированным или неориентированным. Ориентированное алкилирование происходит с присоединением алкильной группы к определенному атому углерода в ароматическом кольце. Неориентированное алкилирование приводит к присоединению алкильной группы к различным атомам углерода в ароматическом кольце.
Алкилирование ароматических углеводородов может проводиться в условиях сильного нагрева или ввода газа, таких как хлор или бром, с применением катализаторов, например, перманганатом калия. Получаемые при алкилировании алкиларены могут подвергаться дальнейшим химическим превращениям, таким как гидрирование, хлорирование и др.
Алкилирование ароматических углеводородов является важным шагом в синтезе различных органических соединений и находит широкое применение в химической промышленности.
24 Сульфирование ароматических углеводородов
Сульфирование представляет собой реакцию замещения одной или нескольких атомов водорода ароматических углеводородов серной кислотой. Эта реакция имеет большое значение в органической химии, так как позволяет получать различные полезные продукты.
Сульфирование может происходить под действием кислого катализатора, например, перманганата калия, при нагревании с бензольным соединением в присутствии концентрированной серной кислоты. При этом происходит замещение атомов водорода ароматических углеводородов на атомы серы. Реакция может протекать с различным составом продуктов в зависимости от условий.
Особенности сульфирования ароматических углеводородов заключаются в том, что оно может протекать в разных направлениях. Например, реакция может привести к полному или частичному замещению всех атомов водорода ароматического кольца серными атомами. Также могут образовываться продукты с замещением только одного атома водорода серой. Виде продуктов сульфирования также может быть наличие заместителей, таких как галогенирование или нитрование.
Для проведения сульфирования ароматических углеводородов используется бромистый калий (KBr) в качестве катализатора. Он обеспечивает реакцию замещения атома водорода атомом брома. При этом возникает бромированное соединение, которое затем реагирует с серной кислотой, образуя сульфонный ангидрид.
Таким образом, сульфирование ароматических углеводородов представляет собой важную реакцию, которая позволяет получать полезные продукты с замещением атомов водорода на атомы серы. Реакция может протекать с различной степенью замещения и с образованием различных продуктов.
3 Окисление аренов
Например, при нагревании толуола (метилбензола) с бромной водой (водой с бромом), происходит окисление бензольного кольца. Формула толуола выглядит следующим образом: C6H5CH3. При окислении в присутствии бромной воды происходит замещение метильной группы гидроксильной группой (-OH), и образуется бензойная кислота (C6H5COOH).
Сильные окислители, например, перманганат калия (KMnO4), могут окислить ароматические соединения, такие как стирол (винилбензол). При окислении стирола с анионами перманганата в кислых условиях образуется бензольная кислота (C6H5COOH) и углекислый газ (CO2).
Окисление ароматической цепи может происходить и в присутствии других окислителей. Например, при окислении мета-хлортолуола (ClC6H4CH3, метил-пара-клорбензол) водным раствором серной кислоты (H2SO4) образуются мета-хлорбензол (ClC6H4CH3) и диоксид серы (SO2).
Также арены могут быть окислены в присутствии сильных окислителей, таких как кислород, при горении. Например, при сжигании бензола (C6H6) в присутствии кислорода формируется диоксид углерода (CO2) и вода (H2O).
Наряду с окислением, арены также могут подвергаться другим реакциям. Например, в реакции электрофильного замещения атомы водорода в ароматической кольце замещаются другими заместителями. Скорость подобной реакции зависит от наличия активирующих или дезактивирующих заместителей. Например, при замещении атомов водорода в орто- и паразаместителях воды хлором (HCl), образуется хлорбензол (C6H5Cl).
Сульфирование аренов – это реакция введения атома серы в ароматическое кольцо. Например, при сульфировании бензола серной кислотой (H2SO4) образуется бензольная сульфокислота (C6H5SO3H).
Таким образом, окисление аренов является общей реакцией, в ходе которой происходит окисление ароматической кольцо и образуется новая связь. При окислении аренов могут образоваться различные продукты в зависимости от условий реакции и свойств используемых окислителей.
31 Полное окисление – горение
Углеводороды имеют и другие свойства. Например, они могут взаимодействовать с кислородом или галогенирование – реакции присоединения галогенов (например, брома или хлора). Реакция галогенирования бензола приводит к получению бромида бензойной кислоты.
Окисление аренов – это реакции присоединения одного атома кислорода или брома к молекуле ароматического соединения. Наиболее интересными из них являются орто- и мета-положение заместителей.
Также, углеводороды могут пройти реакцию нитрования, в которой атом водорода замещается группой NO2. Нитрование проводят из азотной или серной кислоты
Полимеризация углеводородов возможна веществами-инициаторами и без них. Например, полимеризация бутадиена при 10°C протекает без образования цианурнатов карбоната натрия в присутствии 1/100 000 части ферри хорошей кристаллической формы.
| Особенности горения углеводородов: | |
| 1 | Горение протекает в присутствии кислорода или кислородосодержащих соединений |
| 2 | В результате горения образуется углекислый газ и вода |
| 3 | Горение углеводородов характеризуется выделением значительного количества энергии |
| 4 | При горении могут образовываться различные продукты в зависимости от условий реакции и свойств углеводородов |
К полимеризации ароматических углеводородов можно отнести ароматическую полимеризацию ксилола в присутствии заместителей, например этилбензола и его гомологов (толуол, метилбензол и т.д.). Ореол полимеризации ароматических углеводородов разнообразен и обусловлен атомами, присутствующими в молекуле.
Алкилирование аренов происходит второго порядка относительно реагента и третьего атома на ферри-ионе молекулы этилбензола, так как мольный объем карбоната искусственно увеличен введением органической кислоты или метациями органических кислот
32 О кисление гомологов бензола
Свойства ароматических углеводородов, в том числе и бензола, отличаются от свойств непредельных углеводородов из-за особенностей их молекулярной структуры. В бензольном кольце между атомами углерода находятся связи двойного рода, которые в результате окисления образуют перманганатом калия или кислородом превращаются в карбоксильные кислоты. Короче говоря, арены имеют связь в кольце из-за чего они преимущественно окисляются.
Кислоты из этой группы как моно-, так и полиароматические имеют свои ароматические свойства, что обусловляется наличием структурных групп, присоединенных к бензольному кольцу. У таких гомологов ароматических кислот, как фенол, химическое поведение определяется наличием гидроксильной группы, то есть OH группы, а также наличием замещений в ареновой части кислоты.
Примером процесса замещения в ароматических углеводородах может служить алкилирование. Например, при взаимодействии бензола с реагентом такого вида, как этилен, образуется этилбензол, в котором один атом водорода в бензольном кольце замещен на этильную группу. Эти вещества являются громадно важными химическими реагентами. Они находят широкое применение в процессах окисления, окислительного осмоса вызывающего взрыв и замешательство атомов углерода и гидрирования алкиленовых остатков.
Еще одной важной реакцией ароматических углеводородов, в которой целью является получение измененных видов арени, является хлорирование и бромирование аренового кольца. При этом веществе окисления играют важную роль, ибо они присутствуют в реакциях замещения атомов водорода группами -Cl и -Br, в процессе реакций алкилирования и ацилирования и имеют специфичную активность, благодаря которой ускоряют реакции замещения атомов водорода и реагентов в арене. Другой пример замещения атома водорода группой -NO2 (нитро-группа) также указывает на важность атомов с реактивными свойствами.
Таким образом, кислоты из группы ароматических углеводородов проявляют ряд свойств, специфичных для аренов, что делает их важными реактивами и катализаторами в химической промышленности.
Видео:
Получение Брома. Красивые опыты.
Получение Брома. Красивые опыты. by ChemEnergy — высокоэнергетический химический канал. 22,889 views 8 years ago 4 minutes, 59 seconds