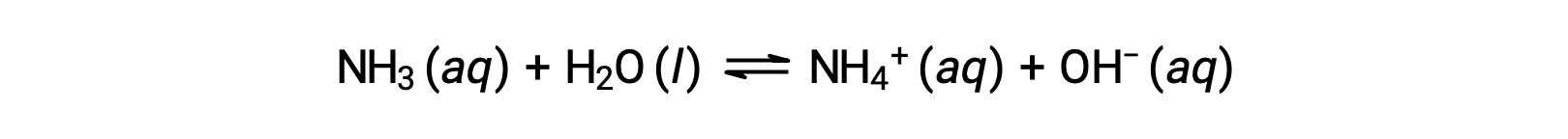Процесс диссоциации аммиака в воде: уравнение и особенности
Диссоциация – это процесс распада молекулы вещества на меньшие частицы под действием электронной структуры и химических связей. В случае аммиака (NH3) и воды (H2O), процесс диссоциации происходит при взаимодействии между молекулами этих реагентов.
Аммиак (NH3) в водном растворе реагирует с водой и диссоциирует, образуя ионы аммония (NH4+) и гидроксидные ионы (OH—). Уравнение диссоциации аммиака с водой выглядит следующим образом:
NH3 + H2O → NH4+ + OH—
Данный процесс происходит спонтанно при комнатной температуре, но его скорость увеличивается при повышении температуры, используя катализаторы, такие как алюминий. Это означает, что в присутствии алюминия аммиак и вода реагируют быстрее и образуют ионы аммония и гидроксида.
Аммиак в водном растворе также может диссоциировать на ионы аммония и гидроксида даже без использования катализатора. Вода является слабым основанием, поэтому ионы гидроксида в этом случае образуются в небольших количествах.
Аммиак получение и свойства
Аммиак может быть получен путем диссоциации аммиака с водой при использовании катализатора. Уравнение реакции диссоциации выглядит следующим образом:
NH3 + H2O ↔ NH4+ + OH—
Это означает, что при реакции аммиак отдает одну из своих молекул воде и образуется аммоний, который диссоциирует на ионы аммония (NH4+) и гидроксидные ионы (OH—).
Аммиак также может быть получен путем реагирования других реагентов, таких как гидроксиды натрия (NaOH) или хлорид алюминия (AlCl3), с аммиаком. Эти реакции позволяют получить аммиак в высокой степени чистоты и образуют нерастворимые соли в водной среде.
У аммиака есть несколько физических свойств. Он имеет низкую температуру кипения (-33,34 °C) при атмосферном давлении и хорошо растворим в воде. Аммиак легко распадается на азот (N2) и воду (H2O) под влиянием катализаторов и высоких температур.
В бытовых условиях аммиак используют в качестве чистящего и отбеливающего средства. Он также используется в промышленности для производства синтетических удобрений, эксплозивов и других химических соединений.
Аммиак – это важное вещество в науке и промышленности, и его свойства и способы получения играют важную роль в процессах производства и исследованиях. Благодаря своим характеристикам, аммиак является важным элементом многих процессов и применений.
Аммиак
Аммиак обычно получают путем диссоциации аммиака в воде при высоких температурах и с помощью катализатора, например, алюминием. В результате реакции образуется раствор аммония.
Уравнение диссоциации аммиака в воде:
NH3 + H2O ⇌ NH4+ + OH—
Аммиак отдает электронную часть своей молекулы и образует аммоний (NH4+) и гидроксид иона (OH—). Реакция происходит в воде и обеспечивает растворение аммиака.
Физические свойства аммиака:
- Аммиак представляет собой газовую форму азота с содержанием аммония.
- Он легко растворяется в воде, образуя раствор аммония.
- Уровень диссоциации зависит от температуры и концентрации аммиака в реакции.
- Аммиак обладает резким запахом, который может быть ощутим даже при низких концентрациях.
Свойства раствора аммиака:
- Раствор аммония обладает щелочными свойствами и может реагировать с кислотами, образуя соли.
- Содержание аммония в растворе можно определить с помощью некоторых реагентов, например, хлорида натрия.
- Обычно содержание аммония в растворе выражается в процентах или степени диссоциации.
Аммиак находит применение в различных областях, включая химию, сельское хозяйство, производство удобрений и многое другое.
Уравнение для диссоциации аммиака в воде — Наука — 2021
Уравнение для диссоциации аммиака в воде выглядит следующим образом:
NH3 + H2O ⇌ NH4+ + OH—
При этом ионы гидроксида (OH—) образуются из воды, а ионы аммония (NH4+) образуются из аммиака.
Данная реакция может протекать самопроизвольно, однако ее скорость может быть значительно увеличена при наличии катализаторов, таких как натрий, алюминий или другие металлы.
Важно отметить, что диссоциация аммиака в воде является обратимой реакцией, что означает, что ионы аммония могут образовывать аммиак при удалении ионов гидроксида. В присутствии хлороводорода (HCl), например, ионы аммония могут реагировать с ионами хлорида (Cl—) и образовывать аммиак:
NH4+ + Cl— → NH3 + H2O + Cl—
Диссоциация аммиака в воде имеет важное практическое значение. Например, аммиак является основным компонентом многих бытовых моющих средств благодаря своим дезинфекционным свойствам.
Для рассчета процента содержания аммиака в водном растворе можно использовать следующую формулу:
(масса аммиака / масса раствора) * 100%
Таким образом, уравнение для диссоциации аммиака в воде играет важную роль в науке и позволяет лучше понять процессы образования и распада молекул воды.
Как рассчитать процент диссоциации
Обычно при растворении гидроксидов аммиака в воде происходит их диссоциация, то есть они распадаются на ионы. Для рассчета процента диссоциации в данной реакции необходимо определить содержание ионов аммония и гидроксида натрия в растворе аммиака.
Рассчитать процент диссоциации можно по следующей формуле: процент диссоциации = (количество ионов аммония / начальное количество аммиака) * 100.
Такие реагенты, как гидроксид аммиака и гидроксид натрия, образуют раствор, в котором происходит образование соли – гидроксида натрия. Натрий в данном случае отдает гидроксид, аммиак же – аммоний. В обычном состоянии аммоний – вещество твердое, нерастворимое в воде, но при взаимодействии с гидроксидом натрия оно диссоциирует под действием воды и образует ионы аммония и гидроксил.
Температура воды в данном случае является важным фактором, так как при повышении температуры количество диссоциировавших молекул аммиака увеличивается. Признаком диссоциации является образование ионов — в данном случае ионы аммония и гидроксида натрия.
Для рассчета процента диссоциации, вам необходимо взять пробирку с избытком раствора аммиака и добавить раствор гидроксида натрия. Здесь можно учесть многие физические свойства альяммоний и гидроксидов натрия, например, их степень растворимости, их положительные свойства в химических реакция и многое другое.
Поместите пробирку с данной смесью в фазе газовой. Отметьте начальное содержание аммиака, затем удалите часть аммиака. В дальнейшем проанализируйте содержание ионов аммония и гидроксида натрия в реакционной смеси. Разница между начальным и конечным содержанием аммиака позволит вам определить процент диссоциации.
Описание распада гидроксида аммиаком на ионы аммония и гидроксида натрия помогает понять принцип диссоциации и формирования ионного раствора. Полученные ионы могут реагировать с другими веществами, образуя тот или иной вид химической связи.
Таким образом, рассчет процента диссоциации в реакции диссоциации аммиака с водой позволяет определить, в каком количестве ионы аммония и гидроксида натрия образовались при данной реакции и каков процент распада аммиака на ионы.
РН уровень аммиака
NH3 + H2O → NH4+ + OH—
Аммиак в водном растворе представляет собой слабую щелочь и может легко реагировать с различными кислотами. РН уровень аммиака зависит от концентрации ионов гидроксида. Чем больше ионов гидроксида образуется в растворе, тем выше будет показатель РН.
Аммиак также может реагировать с некоторыми металлами, образуя нерастворимые соли. Например, аммиак может реагировать с алюминием, образуя алюминий гидроксид – вещество, практически нерастворимое в воде.
РН уровень аммиака может быть рассчитан с использованием специальных формул, которые учитывают концентрацию ионов гидроксида. Например, уравнение Гендерсона-Хассельбальха используется для оценки РН буферных систем, содержащих аммиак и его конъюгированную кислоту, ацетатный буфер (CH3COOH/CH3COO—).
Аммиак также широко используется в промышленности, например, в качестве сырья для получения удобрений. Он обладает высокой растворимостью в воде и хорошо диссоциирует, поэтому может быть использован как источник азота для растений.
Физические свойства аммиака включают неприятный запах, легкую летучесть и химическую реакцию с некоторыми катализаторами. Аммиак также может быть использован для получения других химических веществ, таких как ацетальдегид и гидроксиламин.
Видео:
Водородный показатель (pH). Кислотно-основные индикаторы | Химия ЕГЭ, ЦТ
Водородный показатель (pH). Кислотно-основные индикаторы | Химия ЕГЭ, ЦТ by Адукар 13,180 views 2 years ago 9 minutes, 58 seconds