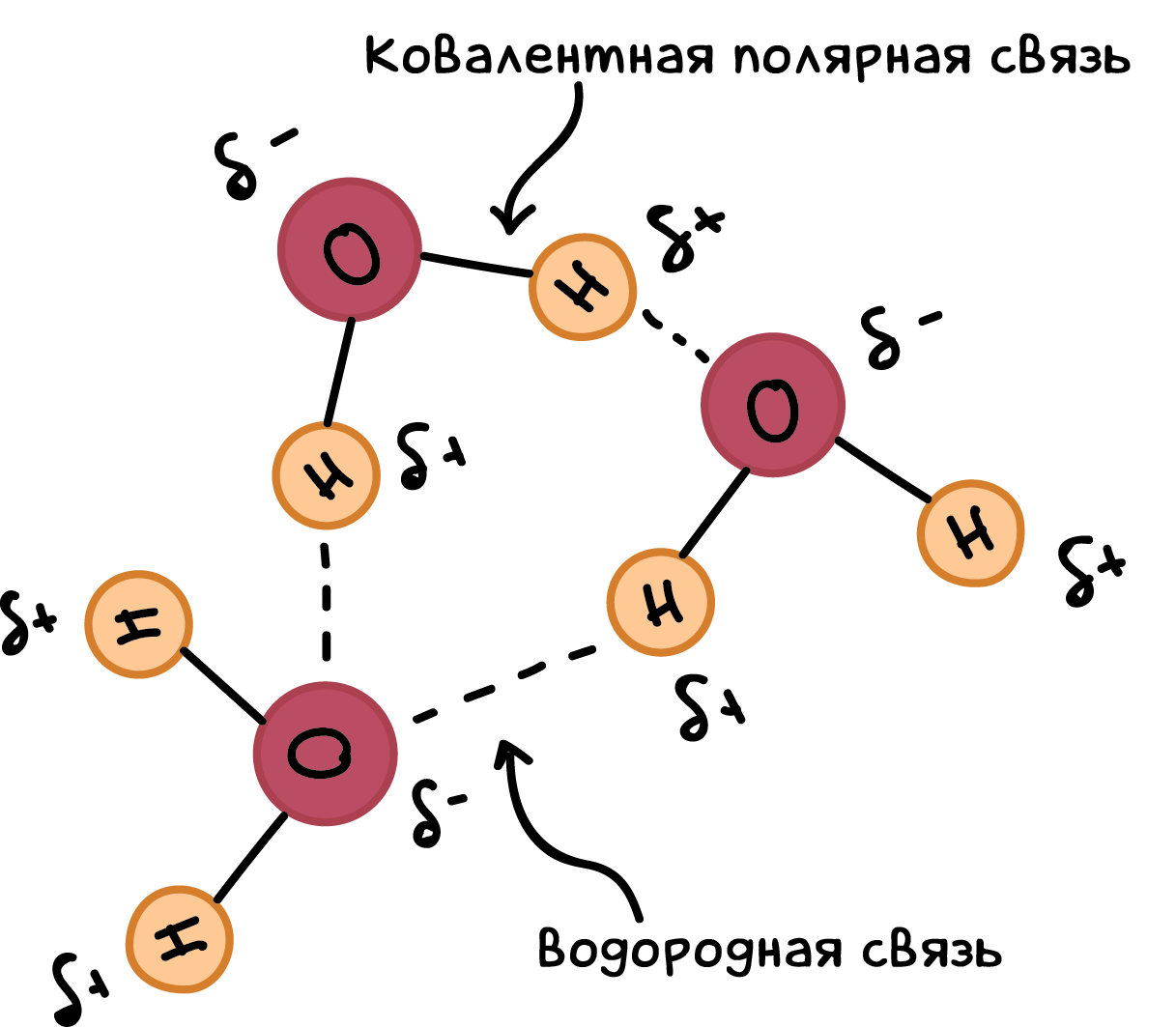- Опыт исследования фтороводорода: его химическое взаимодействие с водой и его возможные применения
- Водород фтористый фтороводород
- Свойства водорода фтористого фтороводорода
- Опасность фтороводорода
- Аварийная карточка АХОВ
- Характеристики фтороводорода:
- Опасные свойства фтороводорода:
- Меры предосторожности при работе с фтороводородом:
- Водород фтористый характеристики и применение
- Свойства водорода фтористого:
- Применение водорода фтористого:
- История открытия
- Свойства фтороводорода
- Применение фтороводорода
- Физические свойства
- Как добывают фторгидрид
- Примечания:
- Полярность молекул HF
- Физические свойства
- Химические свойства
- Химические свойства
- Водный раствор фтороводорода
- Роль плавиковой кислоты в народном хозяйстве
- История открытия и характеристики кислоты
- Применение кислоты в хозяйстве
- Фторсодержащие пластмассы
- Свойства фторсодержащих пластмасс:
- Опасные свойства фторсодержащих пластмасс:
- Примечания:
- Диссоциация фтористого водорода
- Видео:
- Автопротолиз воды (видео 3) | Кислоты и Основания | Химия
Опыт исследования фтороводорода: его химическое взаимодействие с водой и его возможные применения
Фтороводород (HF) – это химическое соединение, состоящее из фтора и водорода. Фтороводород играет важную роль во многих физических и химических реакциях. Это единственное из органических соединений, которое растворяется в воде с диссоциацией на ионы. Это связано с тем, что фтороводород обладает относительно высокой электроотрицательностью элементов, что вызывает его реакцию с водой.
Реакция взаимодействия фтороводорода с водой протекает поэтапно. Сначала происходит диссоциация HF на ионы H+ и F-. Вода играет роль протонного акцептора, получая протоны от фтороводорода. В результате диссоциации образуется гидроксонийный ион (H3O+) и фторидный ион (F-). Таким образом, взаимодействие фтороводорода с водой является химической реакцией ионизации.
Одним из физических свойств фтороводорода является его резкий запах, который человек может ощутить уже при очень низкой концентрации в воздухе. Фтороводород может вызвать раздражение глаз, кожи и дыхательных путей. При длительном воздействии на организм может вызвать серьезные повреждения, особенно в зоне контакта с кожей или слизистыми оболочками. Поэтому при работе с фтороводородом необходимо соблюдать все необходимые меры безопасности, такие как использование специальной защитной одежды и средств индивидуальной защиты.
В промышленных условиях фтороводород находится в газообразном состоянии и используется в основном для производства органических соединений и фторсодержащих веществ. Промышленное производство фтороводорода требует применения специальных газоанализаторов для контроля его концентрации в воздухе. В случае превышения установленного порога, необходимо провести промывание помещений с использованием сульфатной воды.
Водород фтористый фтороводород
Свойства водорода фтористого фтороводорода
Фтороводород обладает рядом опасных свойств, которые делают его особенно опасным. Он имеет сильную реакцию с водой, кожей человека и металлами. Контакт с водой вызывает образование гидрофторной кислоты, что может привести к образованию опасных газообразных соединений.
Роль водорода фтористого фтороводорода в промышленности
Водород фтористый фтороводород широко применяется в промышленности. Из-за своих опасных свойств его применение требует предельно осторожного обращения и использования специальной защиты. В процессе работы с фтороводородом необходимо обеспечить эффективную вентиляцию и защиту от попадания на кожу и в глаза.
Опасность фтороводорода
Фтороводород является весьма опасным веществом. Сильная реакция с водой и кислородом может вызвать образование аварийных ситуаций и опасных газов. Фторводород может вызвать ожоги кожи и поражение глаз. Высокая концентрация фтороводорода в воздухе может привести к серьезным последствиям для здоровья человека.
Водород фтористый фтороводород выделяется солями фтористоводородной кислоты — фтористыми солями. Они играют важную роль в промышленности и хозяйстве, и именно поэтому так важно знать, как защитить себя от вредного воздействия этого вещества.
Что делать при аварийной ситуации с водородом фтористым фтороводородом?
- Остановить и ликвидировать источник выброса вещества.
- Максимально снизить концентрацию опасного вещества в воздухе.
- Обеспечить эвакуацию населения из зоны аварии.
- Промыть кожу и слизистую обильным количеством проточной воды.
- При образовании газов проветрить помещение с помощью средств вентиляции.
Карточка на выживание: что делать при аварийной ситуации с водородом фтористым фтороводородом?
- Остановить распространение вещества.
- Обеспечить эффективную вентиляцию помещения.
- Снизить контакт с кожей и слизистой.
- Промыть кожу и слизистую обильным количеством воды.
- При необходимости обратиться за медицинской помощью.
Аварийная карточка АХОВ
Характеристики фтороводорода:
- Формула: HF (фторгидрид водорода)
- Молярная масса: 20,01 г/моль
- Агрегатное состояние: газообразное при обычных условиях
- Температура плавления: -83,6°C
- Диссоциация: сильная кислота
- Имеет реакцию образования водорода и солей в водном растворе
Опасные свойства фтороводорода:
- Высокая токсичность: влияние фтороводорода на организм человека может вызвать серьезные отравления, ожоги, поражение дыхательных путей
- Крайне опасно для кожи: при попадании на кожу может вызвать ожоги, образование пузырей и болезненные язвы
- Сильная ядовитость воздуха: фтороводород представляет опасность в защитной зоне до 3 км от места хранения или использования
Меры предосторожности при работе с фтороводородом:
- Использование противогазов или респираторов: взаимодействие с фтороводородом требует применения средств защиты дыхательных органов в виде противогазов или респираторов
- Проведение газоанализа воздуха: для контроля концентрации фтороводорода воздуха следует использовать газоанализаторы
- Хранение фтороводорода: фтороводород хранят в гашеной и кальцинированной формах, в хорошо вентилируемых и безопасных помещениях, отдельно от других химических соединений
- Использование нейтрализующих веществ: для нейтрализации фтороводорода можно использовать известь или сульфат кальция
Примечания: Фтороводород является крайне опасным веществом с высокой токсичностью и опасными свойствами. При работе с фтороводородом необходимо соблюдать все меры предосторожности и использовать соответствующие средства защиты. В случае аварийной ситуации с фтороводородом следует незамедлительно обратиться за медицинской помощью.
Водород фтористый характеристики и применение
Основными характеристиками водорода фтористого являются его высокая концентрация, особенно при высоких температурах и давлениях, и его сложная химическая структура. Это вещество представляет собой гидрофильный газ, то есть способный взаимодействовать с водой, превращая ее в фтороводородную кислоту или фтористоводородную кислоту.
Водород фтористый добывают путем взаимодействия фторгидрида с сульфатной кислотой в газообразном состоянии. На промышленных предприятиях водород фтористый используется в качестве реагента при получении фтористого кремния и других соединений фтора. Он также имеет применение в процессах промывания пластика, в производстве минеральных удобрений, в газоанализаторах и в других отраслях промышленности.
Фтористый водород является предельно опасным веществом, которого следует избегать контакта с кожей и глазами. В случае аварийной ситуации или попадания народном дыхания становится необходимым прилагать меры для предотвращения пострадавшему воздействия этого агрессивного вещества. При взаимодействии с водой фтористый водород образует газообразную пленку, которая провоцирует явления химического ожога и вызывает ощущение «ожога» в глазах. Для исключения опасности возникновения жизнеугрожающих состояний, очень важно знать значения концентрации водорода фтористого в атмосфере и предпринимать меры для его предельно возможного сокращения.
Свойства водорода фтористого:
- Ядовитость и высокая агрессивность коже и дыхательным путям человека;
- Способность взаимодействовать с водой и образовывать кислоты;
- Высокие значения концентрации в атмосфере;
- Использование в различных отраслях промышленности;
- Вредное влияние на организм человека и животных.
Применение водорода фтористого:
- Производство фтористого кремния и других соединений фтора;
- Промывание пластмассы;
- Производство минеральных удобрений;
- Изготовление газоанализаторов и других технических устройств.
История открытия
Фтороводород (HF) известен уже более двух столетий. Это химическое соединение было открыто шведским физиком и химиком Карлом Виллемом Шиилем Берзелиусом в 1771 году. Важность этого соединения и его свойства были определены Берзелиусом и его коллегами во время исследований фторидов в 19 веке.
Свойства фтороводорода
Фтороводород — это весьма опасное химическое соединение, которое выделяет ядовитые пары. Водные растворы HF образуются путем растворения фтористого водорода (HF) в воде, при этом образуется кислота фтористоводородная. Этот раствор может вызвать серьезные ожоги при воздействии на кожу и глаза, а также причинить опасность при дыхательном воздействии. Именно эта опасность, связанная с использованием и хранением фтороводорода, стала причиной аварийных ситуаций в промышленности.
Применение фтороводорода
Фтороводород имеет значительное значение в химической промышленности. Он используется для получения различных соединений, таких как фториды, фтористые соли и органические соединения фтора. Также фтороводород играет важную роль в качестве реагента при проведении химических реакций. Он часто используется для этилирования, дезаминирования и других реакций в органическом синтезе.
Физические свойства
Фтороводород является химической кислотой и может реагировать с многими элементами и соединениями. Взаимодействие HF с кальцинированной сульфатной солью вызывает образование плавиковой кислоты, в результате чего образуется бесцветная жидкость. Доля HF в состоянии плавления составляет -83.6°C, а в воде её плотность равна 1.17 г/см3.
Фтороводород является небольшим классом органических соединений, включающих водород. Они используются в различных отраслях промышленности, а также в народном хозяйстве.
Фтороводород играет важную роль в защите от пожара и используется для производства огнетушителей. Это обусловлено его особенностью разрушать химические связи в молекулах огнегасящего вещества, что приводит к диссоциации молекул и образованию водорода, который играет роль редукционного агента.
Для защиты от вредного воздействия фтороводорода используются противогазы и газоанализаторы, которые позволяют определить его наличие в воздухе.
Взаимодействие фтороводорода с водой может вызвать ожоги кожи и слизистых оболочек, поэтому при работе с растворами HF рекомендуется использовать полимерные перчатки и защитные очки.
Следует помнить, что фтороводород является опасным и ядовитым веществом, и употребление его или взаимодействие с ним может привести к серьезным последствиям для здоровья.
Таким образом, физические свойства фтороводорода включают его состояние в низкой температуре, плотность в воде, возможность реакции с другими элементами и соединениями, а также его вредное воздействие на кожу и органы человека.
Как добывают фторгидрид
Для получения фторгидрида используют различные пути. Одним из таких путей является химическая реакция между фторидом и водородом. В результате этой реакции образуется фтороводородный газ. При этом следует учитывать, что фтороводород является очень опасным веществом и его применение требует соблюдения особых мер предосторожности.
Воздействие фтороводорода на организм человека может быть вредным. При контакте с кожей и глазами может произойти ожог или раздражение. Вдыхание газообразной фазы фтороводорода может вызвать рвоту и состояние задушевности. Поэтому в процессе работы с фторгидридом необходима хорошая вентиляция рабочего места, а также использование специальной защиты, такой как противогазы и защитная одежда.
Для получения фторгидрида обычно используют водный раствор фтороводорода. Для этого воду заливают в специальный реактор и добавляют фторид, например, сульфат фтора. В результате этой реакции образуется фторгидрид, который может быть использован в различных промышленных процессах.
Примечания:
- Фторгидрид является одним из самых опасных химических соединений
- Фтороводород обладает рядом уникальных свойств и находит широкое применение
- Воздействие фтороводорода на организм человека может быть вредным
- Получение фторгидрида требует соблюдения особых мер предосторожности
Полярность молекул HF
Физические свойства
- Фтороводород — газообразное вещество.
- Бесцветная жидкость.
- При низких температурах может образовывать плавиковую массу.
Химические свойства
Молекула HF обладает сильной кислотной реакцией. Она растворяется в воде, образуя гашеную серную кислоту. При этом происходит образование ионов H+ и F-.
Фтороводород обладает высокой опасностью для человека. При попадании на кожу он вызывает ожоги, а при вдыхании может возникнуть рвота и отек дыхательных путей.
Фтороводород часто используется в промышленных процессах. Например, он может быть использован для получения гашеной вапы серной кислоты. При этом важно соблюдать меры безопасности, так как вещество опасно для организма человека.
Одним из примечательных свойств молекулы HF является ее способность образовывать слабую пленку гидрофторида на поверхности стекла и камня. Это свойство используется, например, для промывания стекла в оконном хозяйстве.
Химические свойства
Фтороводород эффективно реагирует с различными минеральными и органическими соединениями, а также металлами, образуя фторсодержащие соли и соединения. При взаимодействии с кожей и органами человека фтороводород вызывает раздражение, ожоги и рвоту. Поэтому при работе с фтороводородом необходима защита, включая применение специальных защитных средств и промывание кожи и органов контакта с известковым раствором.
Высокая токсичность фтороводорода и его едкие характеристики определяют необходимость обеспечения безопасности при использовании этого реагента в промышленности и в бытовых целях. В случае аварийного выброса фтороводорода в окружающую среду необходимо дезактивировать его и провести контроль с помощью газоанализаторов.
Фтороводород используется в различных отраслях промышленности. Например, его применяют в производстве стекла, керамики, пластмассы и металлов. В хозяйстве фтороводород применяется для промывания окон, карточек и других поверхностей.
При контакте фтороводорода с водой происходит резкое падение pH, что может привести к образованию опасных соединений, таких как хлоридная и сульфатная кислоты. Чтобы предотвратить развитие нежелательных явлений при взаимодействии фтороводорода с водой, необходимо соблюдать требования безопасности, контролировать концентрацию и температуру растворов, а также выполнять промывание и дезактивацию.
При незначительном воздействии фтороводородной кислоты на организм человека возникает кашель, а при сильном воздействии возможно отравление. Для предотвращения опасных последствий следует избегать непосредственного вдыхания фтороводорода и обеспечить хорошую вентиляцию помещения и ношение средств защиты органов дыхания.
Водный раствор фтороводорода
Водный раствор фтороводорода оказывает сильное влияние на живые организмы. При попадании на кожу или в дыхательные органы может вызывать ожоги, боль и раздражение. Также фтороводород является ядовитым веществом и при проникновении внутрь организма может вызвать серьезные нарушения здоровья, вплоть до смертельного исхода.
Для предельно безопасной работы с водным раствором фтороводорода необходимо соблюдать меры предосторожности, такие как работа в специально оборудованной зоне, использование противогазов, промывание оборудования после работы, ношение защитной одежды и средств индивидуальной защиты.
| Физические свойства водного раствора фтороводорода | Значение |
|---|---|
| Относительная молекулярная масса | 20.01 г/моль |
| Температура кипения | 19.5°C |
| Температура плавления | -83.6°C |
| Диссоциация | HF ↔ H+ + F- |
| Образование примечания раствора HF | HF + H2O → H3O+ + F- |
Фтороводородный раствор широко используется в промышленности, например, для кальцинированной обработки металлов, производства пластмассы и использования в химической промышленности. Также водный раствор фтороводорода применяется в медицине для лечения некоторых заболеваний. Однако, необходимо быть внимательными при использовании данного раствора из-за его опасности и высокой токсичности.
Роль плавиковой кислоты в народном хозяйстве
История открытия и характеристики кислоты
История открытия и использования плавиковой кислоты связана с бурным развитием химической промышленности. В состоянии газообразного пара плавиковая кислота обладает вредным влиянием на органы дыхания человека. Ее высокая концентрация в атмосфере может вызвать серьезные заболевания и оказывать вредное воздействие на живые организмы.
Фтористоводородная кислота выделяет соли, которые имеют характеристики агрегатов такого состояния, в котором можно использовать их в промышленных процессах. Она окисляет многие органические соединения до газообразного состояния в результате химической диссоциации.
Применение кислоты в хозяйстве
Особое значение плавиковая кислота имеет в промышленности. Она используется в производстве алюминия и фторид-содержащих соединений, а также в качестве катализатора. Плавиковую кислоту используют в водных газоанализаторах для определения уровня фторидного загрязнения в воде, что важно для контроля ее качества.
| Применение | Количество, тонны в сутки |
|---|---|
| Производство алюминия | 600 |
| Производство фтористого водорода | 370 |
| Производство фторсодержащих хлоридов | 80 |
Другими словами, плавиковая кислота является важным компонентом промышленных процессов, где она находит применение в различных сферах народного хозяйства, таких как производство строительных материалов, стекла, химической продукции и других отраслей.
Но необходимо помнить, что плавиковая кислота является опасным веществом, и ее использование требует соблюдение соответствующих мер безопасности для минимизации рисков для жизни и здоровья людей.
Фторсодержащие пластмассы
Свойства фторсодержащих пластмасс:
— Высокая химическая стойкость. Фторсодержащие пластмассы обладают устойчивостью к воздействию химически активных веществ, включая кислоты, щелочи и органические растворители.
— Низкая поверхностная энергия. Фторсодержащие пластмассы образуют бурно отталкивающую воду и масла пленку на своей поверхности, что делает их гидрофобными и липофобными материалами.
— Хорошая электрическая изоляция. Фторсодержащие пластмассы обладают высокой стойкостью к электрическим полюсам и обеспечивают эффективную изоляцию в электротехнике.
Опасные свойства фторсодержащих пластмасс:
Фторсодержащие пластмассы опасны при нагревании, так как могут выделять вредные газы, включая фтороводород (HF). Фтороводород является бесцветным газом с резким запахом, и его воздействие на организм человека может привести к отравлению. Низкая доля фтороводорода в воздухе может вызвать рвоту и ослабление. Аварийная ситуация с фторсодержащим пластмассовым изделием может привести к выделению опасных веществ, поэтому важно обеспечить хорошую вентиляцию в рабочей зоне, особенно при работе с пластиками.
Для контроля концентрации фтороводорода в воздухе используют газоанализаторы, которые обнаруживают его наличие и измеряют его концентрацию. Также используют газоанализаторы для контроля концентрации других фторсодержащих соединений, таких как фториды и фторгидриды.
Примечания:
Именно фторгидриды являются наиболее опасными. Взаимодействие фтора и водорода при высоких температурах приводит к образованию фтористого водорода (HF), который является очень коррозионно-активным веществом и обладает высоким ядовитым действием на организм человека. Поэтому при работе с фторсодержащими пластмассами важно соблюдать все меры безопасности, чтобы предотвратить возникновение опасных реакций и защитить органы дыхания и другие органы от воздействия фторогидридов.
Флюорит, основной источник фтора для производства фторсодержащих пластмасс, является водорастворимым. Поэтому при взаимодействии фторсодержащих пластмасс с водой образуются реакции, которые могут привести к образованию фтороводорода. Поэтому важно учитывать этот фактор при использовании фторсодержащих пластмасс в контакте с водой.
Относительная стойкость фторсодержащих пластмасс в водном растворе и в газообразной фазе отличается. Она зависит от типа пластика и концентрации фторсодержащего компонента в материале. В водном растворе фторсодержащие пластмассы частично растворяются и разрушаются, в то время как в газообразной среде они обычно демонстрируют высокую стойкость и сохраняют свои свойства.
Диссоциация фтористого водорода
Диссоциация фтористого водорода происходит при контакте с водой. Сильная реакция происходит из-за химических свойств HF. Когда фтористый водород попадает в воду, он быстро диссоциирует на ионы фторида (F-) и ионы водорода (H+).
Фтористый водород очень реактивен и опасен для здоровья человека и живых организмов. При попадании на кожу или в глаза этот газообразный вещество может вызвать ожоги и серьезные повреждения. Опасен также его воздействие на дыхательную систему, особенно при вдыхании в атмосферу.
Фтористый водород также обладает высокой растворимостью в воде. Это значит, что при контакте с жидкостью уровень диссоциации HF будет достаточно высоким.
Из-за своих химических свойств и особой силы, фтористый водород заливают в специальную плавиковую жидкость или металлы для защиты от аварийной ситуации.
Фтористый водород также может диссоциировать при попадании на другие вещества, например, на минеральные сульфатные соединения. В результате этого процесса образуется газообразный фториды металлов.
Зачем нужна защита от диссоциации фтороводорода? Одна из самых распространенных причин — защита от его взаимодействия с кислородом в воздухе и его окисления.
Диссоциация воды при взаимодействии с фторидным водородом также используется в промышленности, в различных химических процессах. Например, при получении кислоты и продуктов на ее основе.
Карточка истории: в 1771 году французский химик Шарль Виллар (Charles Bernard Desormes) и Аршамбо (Arsène Jacques de Arsonval) впервые получили фтористый водород. Они смешали фтористый калий с серной кислотой и нагрели смесь. При этом образовался газообразный HF.
Видео:
Автопротолиз воды (видео 3) | Кислоты и Основания | Химия
Автопротолиз воды (видео 3) | Кислоты и Основания | Химия by KhanAcademyRussian 4,887 views 5 years ago 9 minutes, 9 seconds