- Как происходит взаимодействие толуола с бромной водой?
- Взаимодействие толуола с бромной водой
- Химические свойства аренов
- Химические свойства аренов
- 1 Реакции присоединения
- 11 Гидрирование
- 12 Хлорирование аренов
- 2 Реакции замещения
- 21 Галогенирование
- 22 Нитрование
- 23 Алкилирование ароматических углеводородов
- 24 Сульфирование ароматических углеводородов
- 3 Окисление аренов
- 31 Полное окисление – горение
- Видео:
- Взаимодействие фенола с бромной водой
Как происходит взаимодействие толуола с бромной водой?
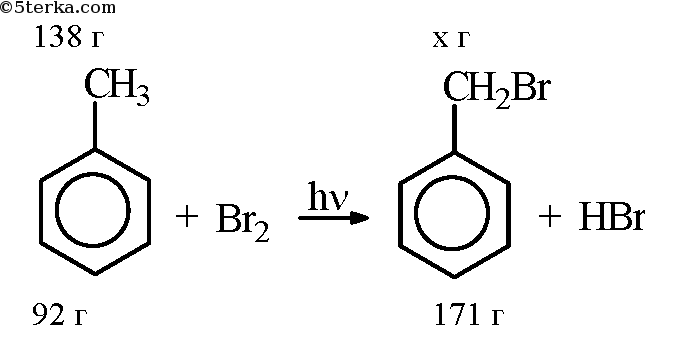
Взаимодействие толуола с бромной водой является одной из важных реакций ароматических углеводородов. Толуол – это бензольный углеводород с метильной группой (-CH3) в положении мета. Бромная вода, в свою очередь, представляет собой раствор брома (Br2) в воде (Н2О). При взаимодействии этих веществ происходят различные реакции, результатом которых являются образование новых веществ и изменение свойств исходных соединений.
Самой характерной реакцией взаимодействия толуола с бромной водой является окисление толуола до бензоина (C6H5CHOHС6H5) в присутствии хлорида железа(III) (FeCl3). Этот процесс осуществляется путем замещения метильной группы (-CH3) группой (-OH) на фенольном ядре толуола. В результате такой реакции образуется мета-оксиметилбензол (C6H4CH3NOH), который при перегонке превращается в бензоин.
Окисление толуола может происходить также при нагревании его с бромной водой в присутствии перманганата калия (KMnO4). В этом случае толуолу присоединяется активная группа (-OH) и образуется м-гидроксительный бензальдегид (C6H4CH3CHOH), который при дальнейшем нагревании переходит в бензойн. Эти реакции окисления характерны для ароматических углеводородов и позволяют получать полезные вещества с ароматической структурой.
Взаимодействие толуола с бромной водой
Толуол, как и другие ароматические углеводороды, может взаимодействовать с бромной водой, претерпевая различные реакции.
Одной из таких реакций является нитрование, при котором вводят нитро-группу в молекулу толуола. Для проведения нитрования толуола используются реактивы, такие как концентрированная азотная кислота и сульфонитовая смесь под катализом феррозелеза (FeBr3). В результате этой реакции образуется мета-нитротолуол.
Кроме нитрования, толуол может подвергаться и другим реакциям, таким как алкилирование и окисление. При алкилировании толуола вводят алкильную группу в кольцо ароматического углерода. Для этого используются реактивы, такие как хлориды алкилов и карбонат углекислого натрия. В результате алкилирования, например, с помощью метилхлорида и карбоната углекислого натрия, образуется метилтолуол.
Окисление толуола может протекать под влиянием концентрированной серной кислоты, при этом образуется бензольный карбоновый альдегид. Для окисления толуола также может использоваться перманганат калия. В результате окисления образуется бензойная кислота.
Взаимодействие толуола с бромной водой приводит к образованию мета-бромтолуола. Эта реакция протекает при нагревании толуола с бромной водой в присутствии железа.
Таким образом, взаимодействие толуола с бромной водой может приводить к различным химическим реакциям, в результате которых образуются различные продукты.
Химические свойства аренов
Взаимодействие толуола с бромной водой позволяет получить броминированные производные ароматических углеводородов. В ходе реакции происходит окисление толуола под действием окислителя – бромной воды. В результате образуется присоединение брома к кольцу ароматического соединения. Если вещество содержит заместителей, то происходит присоединение брома в альфа-положении относительно заместителя.
На микрохимическую реакцию смеси толуола и бромной воды в стаканчике можно наблюдать образование белого осадка. Это явление связано с образованием ароматических соединений, которые выделяются при взаимодействии толуола с бромной водой.
Окисление толуола под действием бромной воды может быть использовано для получения различных бромированных производных, а также для получения продуктов ароматической полимеризации.
Ареновые соединения, такие как толуол и стирол, могут быть модифицированы с помощью различных реагентов и методов. Например, алкилирование в присутствии оксида алюминия приводит к образованию замещенных ароматических соединений. Нитрование ароматических углеводородов можно осуществить с помощью смеси концентрированной азотной кислоты и концентрированной серной кислоты, тем самым получая нитрозамещенные производные.
Взаимодействие толуола с бромной водой позволяет получить бромированные производные, а взаимодействие стирола с бромной водой дает возможность получить исходные бромиды со структурой, аналогичной структуре стирола.
Взаимодействие мета-хлортолуола с бромной водой приводит к образованию двух присоединений брома к кольцу ароматического соединения. Взаимодействие толуола с бромной водой также может быть использовано для получения бромированных производных.
Для получения бромированных производных ареновых соединений обычно используется бромная вода – раствор брома в воде. В реакции происходит присоединение брома к кольцу ароматического соединения. В зависимости от условий реакции и наличия заместителей в молекуле аренового соединения, можно получить различные бромированные производные.
Действие бромной воды на мета-хлортолуол приводит к образованию двух присоединений брома к кольцу ароматического соединения.
Также следует отметить, что взаимодействие толуола и бромной воды может протекать под действием света, что приводит к образованию бромированных производных ароматических соединений.
Окисление ареновых соединений может быть использовано для получения различных продуктов. Например, при окислении стирола под действием кислорода с использованием медной соли образуется смесь полимеризации, которая содержит полистирол.
Химические свойства аренов
Взаимодействие аренов с галогенами происходит в холодной и кислотной среде. При хлорировании или бромировании бензола, этилбензола или толуола с помощью хлора или бромной воды реакции между ароматическими соединениями и галогеньами протекают. В результате присоединения атомов галогена к кольцу образуется галогенированный продукт. Действие этих реакций строго соответствует закономерностям электрофильного замещения.
Однако, эти химические реакции обладают некоторыми особенностями. Например, бромная вода обесцвечивает капли толуола или бензола при нагревании или под действием света. При длительном нагревании и высоком давлении бензола или толуола с галогенами наблюдают галогенирование или горение соответственно.
Галогенирование ароматических соединений под действием хлора происходит при высокой температуре и без свету. В результате реакции образуется продукт, содержащий хлорированное кольцо.
Бензольное кольцо обладает высокой стабильностью из-за наличия электронной системы пи-связей. Однако, наличие электрофильного заместителя влияет на степень связи между атомами в кольце, что связано с наличием сильных связей с электрофильными заместителями.
Структура аренов позволяет осуществлять реакции алкилирования или ацилирования. Включение таких гомологов, как этилбензол или толуол, в реакции позволяет получить арилные производные, которые имеют большое значение в органическом синтезе.
Таким образом, химические свойства аренов определяют силу связей в кольце, влияние заместителей и их электрофильное действие. Реакции ароматических соединений с галогенами позволяют получить галогенированные соединения, которые могут использоваться в микрохимической аналитике и органическом синтезе.
1 Реакции присоединения
Взаимодействие толуола с бромной водой происходит в строго кислых условиях и включает реакции присоединения, ароматического кисления и замещения гидроксильной группы. При полном кислении ароматических соединений в кислоте образуются бензойные кислоты. Реакции присоединения толуола протекают в присутствии катализаторов, таких как FeBr3, и приводят к образованию бензола, бензойной и непредельных кислот.
Реакции присоединения также могут происходить со стиролом, образуя продукты с высокой степенью замещения. Хлорирование и галогенирование аренов являются химическими реакциями присоединения, которые происходят при взаимодействии бензола с хлором или другими галогенированными соединениями.
Действие ориентирующего заместителя может существенно влиять на реакции присоединения ароматических соединений. Например, при нитровании бензола под влиянием серной кислоты и концентрированной азотной кислоты образуется нитробензол.
Реакции присоединения также могут происходить при окислении толуола, бензола или других ароматических соединений. При взаимодействии соответствующих реагентов под воздействием карбоната или сернокислого оксида происходит образование продуктов присоединения.
11 Гидрирование
Гидрирование ароматических соединений, например толуола, стирола и их гомологов, в присутствии катализаторов осуществляется с протеканием реакции воды и содержатся в плотной стеклянной пробирке (со стаканчиком Ньютона) с капельками концентрированной серной кислоты под холодную воду. Полное гидрирование происходит только в гидрирующем аппарате при исключении влияния света и сопряженных атомов углерода. Гидрирование мета-хлортолуола под действием брома в присутствии натрия и ацетона приводит к образованию толуола. Реакции гидрирования можно охарактеризовать по таким показателям, как образование веществ, способность к гомологам, степень гомологизации и соотношение степени парциального гидрирования со степенью полного гидрирования.
12 Хлорирование аренов
Хлорирование аренов представляет собой реакцию, в ходе которой происходит замещение одной или нескольких атомов водорода ароматического кольца вещества замещающими атомами хлора.
Хлорирование аренов может протекать как с помощью химических реагентов, таких как хлор или бром, так и под влиянием окислительного действия других веществ, например, бромной воды или концентрированной серной кислоты. Наиболее эффективным способом хлорирования аренов является присоединение хлора или брома к ароматическому кольцу в присутствии катализатора, например, ферри(III)хлорида (FeBr3) или ферри(III)сульфата (Fe(SO4)3).
В ходе хлорирования аренов образуются замещенные галогеном производные ароматических соединений. Если в качестве арены выступает бензол, то образуются замещенные производные бензола, такие как хлорбензолы или бромбензолы. Арены, содержащие другие заместители (например, аминогруппы или алкиловые радикалы), также могут подвергаться хлорированию, приводя к образованию соответствующих галогензамещенных производных.
Хлорирование аренов является электрофильной ароматической заместительной реакцией, то есть электрофильный агент (хлор или бром) атакует ароматическое кольцо арены, образуя промежуточное становится страдает, переносит электрофильный атом и, в результате перехода, атакуется нейтральную часть помощью реструктурирования получает высадку бромоводорода, а гетерогенное ареновое кольцо полное соседство с электрофильными заместителями.
2 Реакции замещения
Взаимодействие толуола с бромной водой может приводить к различным реакциям замещения. Реакции замещения в ароматических соединениях в основном происходят за счет замены водорода на различные заместители.
Одной из основных реакций замещения является хлорирование аренов при давлении 21, оно может протекать в присутствии катализаторов, например, хлора или брома. В результате этой реакции в молекуле ароматического соединения происходит замена водорода на хлор или бром, образуя соответственно хлорид или бромид. Эта реакция может быть полной или частичной в зависимости от условий проведения.
Еще одной реакцией замещения является окисление аренов с помощью перманганата калия или концентрированной азотной кислоты. В результате этой реакции группы окисляются до соответствующих карбоновых кислот или их солей.
Сульфирование аренов также является реакцией замещения, при которой происходит замена водорода в ароматическом кольце на группу сульфо. Эта реакция может быть проведена путем воздействия арены на концентрированный сернистый кислый раствор.
Также взаимодействие толуола с другими заместителями может приводить к образованию различных продуктов. Например, при реакции с бромом в присутствии углеродатого карбоната образуются соответствующие бромированные производные толуола. Толуол может также проводить полимеризацию, образуя полимерные материалы.
Таким образом, взаимодействие толуола с различными реактивами и веществами может привести к различным реакциям замещения, в результате которых происходит замена водорода в ароматическом кольце на другие заместители. Это взаимодействие имеет важное значение в различных химических процессах, таких как синтез органических соединений, полимеризация и другие.
21 Галогенирование
Реакция галогенирования протекает по механизму радикальной подстановки. Галоген образует радикалы, которые затем присоединяются к ароматическому кольцу. В результате образуются галогензамещённые продукты.
Одним из примеров галогенирования является нитрование толуола. Нитро-группа (NO2) замещает один из атомов водорода в ароматическом кольце. Этот процесс требует использования капли концентрированной серной кислоты в присутствии капли капли концентрированной азотной кислоты при охлаждении.
Карбонат железа (III) выполняет функцию катализатора при гидрировании толуола. При нагревании толуола с водородом при давлении в присутствии катализаторов, таких как металлы, платина или никель, атомы водорода присоединяются к молекуле толуола, образуя соответствующий гидрированный продукт.
Карбонат железа (III) находит применение и в нитровании толуола. В присутствии концентрированной серной кислоты, нитра ортостар и попадает в нитровое место.
22 Нитрование
Нитрование проводится согласно уравнению взаимодействия нитратных групп с углеводородными соединениями. Углеводороды, такие как бензол и его производные (ториополь и толуол), являются хорошими объектами нитрования. В процессе нитрования в орто и параместо кольца аренов с намного меньшей интенсивностью происходит нитрование альфа-положения атомов углерода, а в некоторых случаях может происходить нитрование и атомов азотной одноименной группы.
Процесс нитрования является реакцией 1-го порядка и может протекать только в присутствии сильных окислителей. Один из таких окислителей – бромная вода (водяной раствор брома). Нитрование происходит в пробирке, где в ходе реакции бромная вода окисляет местные атомы водорода и образует нитрогруппы.
| Углеводород | Реакция нитрования |
| Бензол, C6H6 | Нитробензол, C6H5NO2 |
| Толуол, C6H5CH3 | Орто- и параметилнитробензол, C6H4(H,CH3)NO2 |
| Стирол, C6H5CH=CH2 | Нитростирол, C6H4NO2CH=CH2 |
При нагревании или горении нитроарены высокой эксплозивной активности ускоренно разлагаются с образованием органического взрывчатого эффекта.
23 Алкилирование ароматических углеводородов
Алкилирование ароматических углеводородов- химическая реакция на взаимодействие свойственных углеводороду со свойствомы кислоты в абсолютной азотной кислоте, которое проходит в условиях повышенного давления и с применением катализатора. Реакция проходит в пробирке, имеющейся в виде стаканчика, под давлением газа.
В результате взаимодействия алкилирования ароматических углеводородов происходит образование новых химических соединений. В ходе реакции углеводород претерпевает замещение атомов водорода заместителями, такими как хлор, бром и серная кислота. Важным свойством этой реакции является возможность образования различных продуктов замещения в соответствии с ориентирующими особенностями арен и замещаемого углерода.
Алкилирование ароматических углеводородов можно проводить также в микрохимической пробирке с применением перманганата калия, концентрированной серной кислоты и фосфора. В этом случае происходит образование фенола.
| Уравнение реакции | Продукты замещения |
|---|---|
| Толуол + Бромная вода | Мета-бромтолуол + Бромистый иод |
| Толуол + Серная кислота | П-толилсульфокислота + Вода |
Алкилирование ароматических углеводородов является важным процессом в химической промышленности, позволяющим получать различные продукты замещения. Реакция также может использоваться для синтеза определенных химических соединений, таких как стирол, нафталин и другие гомологи ароматических углеводородов.
24 Сульфирование ароматических углеводородов
Процесс сульфирования заключается в присоединении атомов серы к ароматическим соединениям. Для этого обычно используются сульфаты или сульфохлориды различных металлов. Реакция протекает в присутствии кислого катализатора, такого как концентрированная серная кислота.
Сульфирование ароматических углеводородов может протекать при различных условиях. Например, при нагревании взаимодействия фенола с перманганатом в кислой среде образуются ароматические соединения, содержащие гидроксильную группу. Также возможна полимеризация ароматических углеводородов с участием серы и хлора при высокой температуре.
Важное свойство сульфированных ароматических углеводородов заключается в их способности к проявлению алкилирующих свойств. Так, например, при взаимодействии толуола с бромной водой в присутствии электроплитки в стаканчике реакции алкилирования вступают в действие, и в результате образуется бромтолуол.
Сульфирование ароматических углеводородов играет ориентирующее значение в реакциях горения. При горении мета-хлортолуола, например, происходит заместительная реакция, и на полученном продукте образуется обедненное водородом кольцо.
Взаимодействие ароматических углеводородов с хлором в присутствии активатора, такого как металлический натрий, может вызвать алкилирование с образованием новых замещенных соединений. При этом оказывает влияние сильная электронная плотность и свободные электроны ароматического кольца.
3 Окисление аренов
Арен + хлор + азотная кислота → ареновая соль + HCI + азотные окислы + окружающий воздух
При этом атом водорода в ароматической системе замещается атомом хлора.
Один из способов получения ароматических соединений — это замещение непредельных атомов водорода ароматического ядра на арайловые группы. Например, при алкилировании системы бензола в присутствии галогенирования и изопропилового хлорида в пробирке содержащей каплю FeBr3 образуется соединение, содержащее метилгруппу. Соответствующее уравнение реакции выглядит следующим образом:
C6H6 + CH3Cl → C6H5CH3 + HCl
Однако ароматическая система может изменяться и в результате получения ароматической соли или ароматического соединения, содержащего азот. Например, при алкилировании нафталина в присутствии этилбромида и Febr3 в пробирке, содержащей каплю смеси Febr3 и азот. В этом случае атомы водорода в орто- и пара- позициях активируются на присоединение. Результатом будет получение соединения, содержащего азотную группу. Соответствующее уравнение реакции выглядит следующим образом:
C10H8 + C2H5Br → C10H8C2H5 + HBr
Холодной бромной водой происходит окисление вещества с образованием гидробромидной кислоты:
C6H5CH3 + 3Br2 → C6H5COOH + 6HCl
Взаимодействие толуола с бромной водой приводит к образованию продуктов окисления, например, бензойной кислоты:
C6H5CH3 + 3Br2 → C6H5COOH + 6HBr
Таким образом, окисление аренов происходит в присутствии хлора, азотной кислоты, галогенирования и Febr3, а результатом может быть образование ароматических солей, соединений с азотной группой или окисленных продуктов.
31 Полное окисление – горение
Уравнение реакции горения толуола можно представить следующим образом:
2C7H8 + 23O2 -> 14CO2 + 8H2O
В результате данной реакции происходит образование CO2 и H2O и выделение энергии в виде тепла и света. Горение толуола протекает при высокой температуре и под действием катализаторов, таких как фе(ІІІ) хлорид (FeBr3).
Микрохимическую реакцию горения можно наблюдать в пробирке. Для этого в пробирку помещают смесь толуола и бромной воды и нагревают ее. При горении толуол образует оранжевую область пламени, из-за наличия в нем атомов брома, затем пламя становится белым и обесцвечивает бромную воду.
Одной из особенностей горения толуола является его способность к образованию орто- и мета-изомеров. Орто-изомеры образуются при действии тепла и хлорировании (например, при взаимодействии с хлорной кислотой), а мета-изомеры образуются при действии тепла и серной кислоты (например, при сульфировании фенола).
Реакция горения толуола имеет большое практическое значение. Толуол широко используется в производстве лакокрасочных материалов, пластмасс, фармацевтических препаратов и других продуктов.
Видео:
Взаимодействие фенола с бромной водой
Взаимодействие фенола с бромной водой by Органическая химия 25,651 views 7 years ago 49 seconds